Advanced Science丨吕志民团队开发靶向抑制SREBP活化阻断肿瘤脂质合成与生长的多肽分子
近年来,吕志民教授团队研究发现多种代谢酶具有“兼职”功能,如某些代谢酶可发挥蛋白激酶活性,参与调控信号转导和基因表达等。这一发现为理解细胞生命活动的复杂调控机制提供了全新视角。由于代谢酶的双重功能在肿瘤中扮演关键角色,针对其激酶活性的抑制剂可能成为新型治疗策略。探索代谢酶如何在不同环境下切换“代谢酶-蛋白激酶”模式,将有助于揭示更广泛的细胞调控网络,为疾病治疗提供新的靶点。
近日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心吕志民教授团队、浙江大学高分子科学与工程学院毛峥伟教授和浙江大学转化医学研究院/浙江大学医学院附属第一医院许大千教授等在Advanced Science上发表了题为Inhibition of Tumor Lipogenesis and Growth by Peptide-Based Targeting of SREBP Activation的研究论文,本研究设计了一种模拟内质网跨膜蛋白Insig1/2第一环区(loop 1)氨基酸序列的多肽,该多肽能够特异性结合AKT磷酸化的磷酸烯醇丙酮酸羧化激酶1(PCK1),阻断PCK1与Insig1/2之间的相互作用,从而抑制Insig1/2关键位点的磷酸化,并阻遏SREBP1/2的核转位及其转录活性。这一机制最终导致脂质合成相关基因的表达下调,并显著抑制肿瘤细胞增殖。为推进该多肽分子的药物转化进程,研究进一步采用工程化脂质体纳米粒(LNP)对该肽段进行封装,实现了高效靶向递送。在小鼠模型中,该递药系统显著抑制了肝癌的生长,且与仑伐替尼或司美格鲁肽联用表现出协同抗肿瘤效应。该工作不仅为靶向传统上“不可成药”的转录因子SREBP提供了新型多肽干预策略,也为代谢重编程相关肿瘤的治疗提供了潜在的联合用药方案。

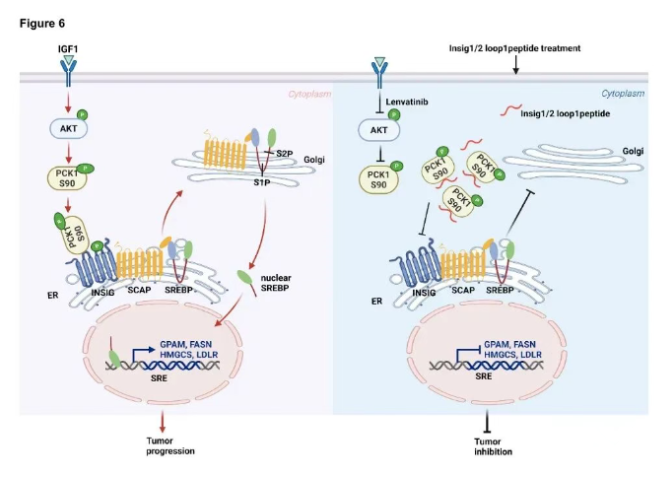
脂质代谢重编程是肿瘤细胞的基本特征之一,并与肿瘤的发生发展密切相关。固醇调节元件结合蛋白(SREBP)家族作为脂质代谢的核心调控因子,自1993年被Brown和Goldstein团队首次发现以来,已成为代谢性疾病和癌症治疗领域的研究热点。吕志民团队于2020年在Nature(PMID: 32322062)上发表的研究表明,在酪氨酸激酶受体(RTK)或KRAS激活的肿瘤细胞中,AKT磷酸化PCK1的90位丝氨酸,从而导致磷酸烯醇丙酮酸羧化激酶1(PCK1)发生内质网易位,使其失去了原本的糖异生代谢酶功能并获得了蛋白激酶功能。PCK1作为蛋白激酶以GTP作为磷酸基供体,磷酸化Insig1/2使其与细胞内脂质的结合出现障碍,进而促进SREBP信号通路的激活及肿瘤细胞的脂质合成。
基于团队前期研究,本研究发现在肿瘤细胞中,Insig1/2蛋白的第一环区(loop1)在PCK1 S90位点磷酸化后与Insig1/2的结合过程中起关键作用。抑制二者的结合可有效阻断PCK1介导的Insig1/2磷酸化,进而抑制SREBP的转录激活功能,最终抑制肿瘤细胞的脂质供应。基于这一机制,本研究设计了一种模拟Insig1/2第一环区(loop1)氨基酸序列的多肽分子,该多肽能够特异性结合AKT磷酸化的PCK1蛋白,阻断其与Insig1/2的相互作用,从而抑制Insig1/2关键位点的磷酸化,阻碍SREBP1/2的核转位及转录活性,显著降低脂质从头合成相关基因的表达水平并抑制肿瘤细胞增殖。
多肽药物因其高亲和力、高选择性、低毒性以及易于合成等优势,被视为理想的药物分子。然而,多肽在体内易被酶降解,并可通过肾脏快速滤过,导致其血浆半衰期通常仅几分钟,这严重限制了其临床应用。为提升多肽的成药性,本研究采用工程化脂质体纳米粒(LNP)对该肽段进行封装,并进一步对递送系统进行优化,将肽段包封于直径约136.83 nm的LNP中,并在其表面以1:1的比例修饰细胞穿膜肽TAT与肿瘤靶向肽cRGD。该设计不仅显著延长了多肽的体内循环时间,还提高了其在肿瘤组织中的特异性富集。实验结果显示,LNP封装后的肽段血浆半衰期较游离肽延长近9倍,药时曲线下面积(AUC)增加15.1倍,并在肿瘤部位维持48小时的有效滞留。
在多种肿瘤细胞及肝癌动物模型中,LNP@Insig1/2 loop1 peptide表现出显著抗肿瘤效果。该制剂不仅可单药抑制肿瘤生长,还能与临床常用的抗肿瘤药物发挥协同效应。与酪氨酸激酶抑制剂仑伐替尼联用后,抑瘤效果增强,肿瘤细胞凋亡增加,荷瘤小鼠生存期显著延长,为克服仑伐替尼临床耐药提供了新策略。更有趣的是,在与降糖药物司美格鲁肽联合应用时,在高脂饮食诱导的小鼠肝癌模型中观察到叠加抗肿瘤效应——该多肽抑制脂质从头合成,而司美格鲁肽降低循环脂质水平,二者共同作用彻底阻断肿瘤细胞的脂质供给。
此外,本研究还对LNP@Insig1/2 loop1 peptide的靶向性和安全性进行了系统评价。结果表明,该制剂可特异性靶向肿瘤细胞中异常活化的SREBP通路,而不干扰正常肝组织的脂质代谢。在小鼠模型中未发现其对心、肝、脾、肺、肾等主要脏器功能或组织形态产生明显毒性,显示出良好的安全性特征。
综上所述,本研究的发现不仅是SREBP靶向治疗领域的概念突破,更引领了肽类分子药物研发的新模式,为治疗此前被认为“不可成药”的转录因子相关疾病奠定了坚实基础,临床转化价值显著。
浙江大学转化医学研究院的博士研究生罗书笛、浙江大学医学院博士后杨黄和浙江大学转化医学研究院的博士研究生蒋孝明为论文并列第一作者。吕志民教授、毛峥伟教授和许大千教授为本论文的共同通讯作者。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202508111


