Advanced Science丨张普民团队揭示UHRF1-RFWD3-RAD51负反馈环路调控同源重组修复的分子机制
2025年9月12日,浙江大学转化医学研究院/医学院附属第一医院张普民教授团队在国际权威期刊Advanced Science上发表了题为“UHRF1 Controls the Timing of RAD51 Removal During DNA Damage Repair Through Suppressing RFWD3”的研究论文。该研究揭示了在同源重组(Homologous recombination, HR)修复过程早期,细胞如何精确调控同源重组核心蛋白RAD51的蛋白稳态以有效促进同源重组修复的分子机制。

HR是一种高保真修复途径,其核心步骤包括:DNA末端切除、RAD51蛋白在ssDNA上的组装、同源搜索、链侵入以及DNA合成与连接。在这一过程中,RAD51通过与ssDNA结合,形成具有高度有序结构的核酸-蛋白丝状复合体(nucleoprotein filament),该复合体不仅能够保护ssDNA免受核酸酶降解,更重要的是具备识别同源序列并进行链配对的能力,从而实现精确的DNA修复。值得注意的是,RAD51在完成同源搜索与链配对后,必须及时从DNA上解离,以便后续的DNA合成与连接步骤顺利进行。已有研究表明,泛素连接酶RFWD3(ring finger and WD repeat domain 3)在这一过程中扮演了“清除者”的角色。RFWD3能够识别并结合RAD51,通过催化其多聚泛素化修饰,然后靶向至蛋白酶体进行降解,从而实现RAD51从DNA链上的高效移除。这一机制不仅确保了HR修复的有序进行,也避免了RAD51在DNA上的异常滞留可能引发的基因组不稳定性。
然而,一个关键的科学问题尚未解决:在HR修复的早期阶段,以及在没有DNA损伤的生理状态下,RFWD3为何不会过早地攻击并降解RAD51?这一“保护机制”的存在对于维持RAD51在细胞内的基础水平、确保其在DNA损伤发生时能够迅速响应至关重要。
本研究首次阐明了UHRF1作为RFWD3的E3泛素连接酶调控同源重组修复的分子机制。具体而言,UHRF1通过其RING结构域的泛素连接酶活性,介导RFWD3的多聚泛素化修饰并促进其蛋白酶体依赖性降解。这一调控过程有效抑制了RFWD3对RAD51的过早降解,从而维持RAD51蛋白的稳定性及其在DNA损伤修复中的功能。令人惊奇的是,RAD51作为被RFWD3所摧毁的对象却反过来保护RFWD3不被UHRF1泛素化降解,因为RAD51还是个UHRF1 E3连接酶的抑制剂(Liu, et al., PNAS, 2024)。由此,UHRF1、RFWD3 及RAD51形成一个三级负反馈环路以确保RFWD3与RAD51的蛋白水平不过高也不过低。此外,研究进一步阐明,RFWD3的泛素化进程受UHRF1磷酸化状态的精确调控,而CDK2和磷酸酶PP4在这一过程中发挥关键调节作用,通过影响UHRF1的磷酸化状态调控UHRF1与RFWD3的相互作用从而间接维持RFWD3的蛋白水平。综上所述,本研究系统揭示了一个由UHRF1-RFWD3-RAD51构成的调控网络,通过多层次、动态的反馈机制确保RAD51在HR修复过程中维持在最适水平,从而保障基因组稳定性和修复效率。
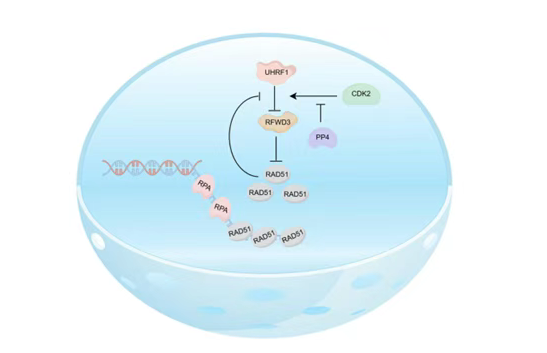
UHRF1-RFWD3-RAD51负反馈环路调控同源重组修复的模式图
浙江大学医学院附属第一医院特聘研究员刘光学为论文第一作者和共同通讯作者,浙江大学医学院转化研究院博士研究生黄开颜为共同第一作者,张普民教授为该论文通讯作者。该论文得到国家自然科学基金面上项目和浙江大学医学院附属第一医院特聘研究员启动经费等项目的经费支持。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.20250990


