Advanced Science丨赵永超/熊秀芳团队揭示FBXW7-RPAP2轴在肝癌发生和肝脏细胞命运决定中的关键作用与机制
磷酸酶RPAP2通过将RNA聚合酶II复合物大亚基(RPB1)的羧基末端结构域(CTD)去磷酸化,并协助在细胞质中合成和组装的RNA聚合酶II复合物转运至细胞核,从而在基因转录过程中发挥关键作用。然而,目前关于RPAP2的研究主要集中在其对转录起始和终止等过程的调控功能,而对其在其他生物过程,尤其是在肝癌发生发展中的作用了解甚少。此外,调控RPAP2功能和蛋白稳定性的上游信号通路仍完全未知。
2025年2月11日,浙江大学附属第一医院/浙江大学转化医学研究院赵永超研究员团队与浙江大学转化医学研究院熊秀芳副教授/浙江大学附属第一医院梁廷波、崔丹蕊团队合作,在《Advanced Science》杂志上发表题为“The FBXW7-RPAP2 Axis Controls the Growth of Hepatocellular Carcinoma Cells and Determines the Fate of Liver Cell Differentiation”的研究论文。该研究首次揭示了RPAP2的促癌特性,并阐明了泛素连接酶FBXW7通过靶向降解RPAP2来抑制肝癌细胞生长及调控肝脏细胞分化的分子机制,为靶向原癌蛋白RPAP2的治疗提供了新的策略。

在本研究中,研究者首先通过分析TCGA数据库中32种人类肿瘤样本,发现RPAP2的mRNA仅在肝癌患者中显著升高,且与患者的不良预后密切相关。随后,利用免疫印迹和免疫组化技术,研究者在蛋白水平上进一步证实RPAP2在肝癌组织中显著高表达,且其表达水平与患者的不良预后呈明显负相关。通过体外细胞实验和体内裸鼠成瘤实验,研究者发现敲低RPAP2能够抑制肝癌细胞的生长和存活;相反,过表达RPAP2则促进肝癌细胞的生长和存活,表明RPAP2在肝癌进展中具有促癌作用。鉴于RPAP2在细胞生长和存活中的关键调控作用,研究团队结合串联亲和纯化联合质谱、生物化学、细胞生物学以及转基因小鼠等多种技术手段,系统揭示了调控RPAP2蛋白稳定性的精细分子网络。
在生理条件下,RPAP2是SCFFBXW7 E3泛素连接酶的底物,其Ser562和Thr565位点分别被p38和GSK3磷酸化后,促进FBXW7识别并降解RPAP2。同时,RPAP2被鉴定为HSP90的新Client蛋白。在HSP90抑制剂作用下,HSP90的辅助分子CDC37与RPAP2分离,并通过非经典的CRL5FBXW7 E3泛素连接酶途径快速降解RPAP2,从而增强肝癌细胞对HSP90抑制剂的敏感性。此外,USP7通过去泛素化作用稳定RPAP2。在生物学功能方面,敲低FBXW7在体外和体内均通过RPAP2的累积促进肝癌细胞的生长和存活。
值得注意的是,小鼠肝脏特异性敲除Fbxw7后,在12月龄左右并未观察到明显的肝脏肿瘤发生,但诱发了显著的肝囊肿,并伴随RPAP2的明显累积。组织学和免疫组化分析显示,肝囊肿细胞来源于胆管系细胞的扩增,而同时敲除Rpap2则完全逆转了肝囊肿的形成。此外,在6-9月龄的小鼠中,肝脏特异性敲除Fbxw7诱发了明显的脂肪肝,同时敲除Rpap2也能够逆转脂肪肝的形成。这些结果表明,FBXW7-RPAP2轴在肝脏脂肪形成和肝脏细胞的分化命运决定过程中发挥重要作用。
综上所述,本研究证实RPAP2的蛋白稳定性同时受到FBXW7的负向调控以及HSP90和USP7的正向调控。FBXW7-RPAP2轴不仅调控肝癌细胞的生长,还决定肝脏细胞分化的命运(图1)。这一发现为深入理解RPAP2在肝癌发生发展中的作用提供了新的视角,并为靶向RPAP2的抗肝癌治疗策略奠定了理论基础。
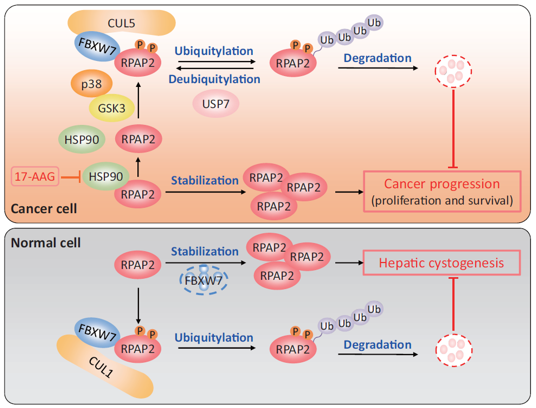
图1. FBXW7-RPAP2轴调节肝癌发生和肝脏细胞分化的机制模式图
浙江大学附属第一医院特聘研究员崔丹蕊博士为第一作者和共同通讯作者,浙江大学附属第一医院/浙江大学转化医学研究院赵永超研究员、浙江大学转化医学院/浙江大学附属第二医院熊秀芳副教授和浙江大学附属第一医院梁廷波教授为共同通讯作者。本研究得到浙江大学转化医学研究院/浙江大学附属第二医院孙毅教授和浙江大学附属第一医院宋鹏红教授的大力支持和帮助。该研究得到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金及浙江大学医学院附属第一医院特聘研究启动经费等项目的资助。
原文链接: http://doi.org/10.1002/advs.202404718


