封面文章丨专家点评丨Advanced Science:闵军霞/王福俤团队发现胚胎造血干细胞锌离子转运蛋白

近日,闵军霞/王福俤教授团队在国际学术期刊《Advanced Science》(Q1, 影响因子17.521 )发表了题为“The Zinc Transporter SLC39A10 Plays an Essential Role in Embryonic Hematopoiesis”的研究论文。
全文免费下载链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202205345

论文Online发表网页截图
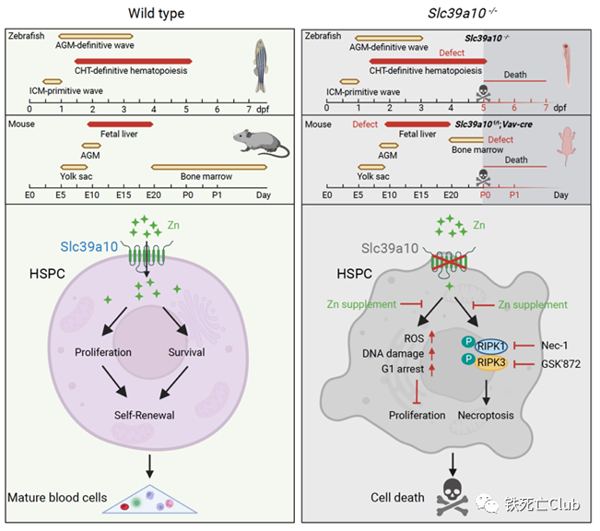
该研究首次发现SLC39A10膜蛋白是早期胚胎造血干细胞关键锌转运蛋白。本文利用小鼠和斑马鱼模型充分证明SLC39A10基因缺失会引起胚胎造血干细胞内锌缺乏并最终引发以程序性坏死(Necroptosis)为主的细胞死亡,揭示锌稳态在胚胎造血发育过程中起重要作用,为探索血液相关疾病防治策略打下理论基础。
锌作为必需微量元素,其稳态对维持细胞以及生命体正常的生理功能至关重要。锌缺乏会引起生长迟缓、免疫紊乱、认知障碍、性腺机能衰退等一系列临床表现;而锌过量也会干扰铜铁等其他微量元素的吸收与利用,甚至引发锌中毒[1, 2]。据世界卫生组织报道,锌缺乏仍是目前全球人群面临的重要营养失衡性挑战之一。
微量元素锌为人体新陈代谢所必需。锌离子进出细胞以及稳态维持主要依赖于金属离子转运蛋白家族SLC39A和SLC30A。SLC39A家族(又名ZIP家族)包含14个成员,负责离子从细胞外或细胞器运输到细胞质[3];SLC30A家族(又名ZnT家族)包含10个成员,负责离子从细胞质运输到细胞外或细胞器[4](见下图)。锌离子和锌转运蛋白不仅能够作为重要的结构/催化因子调节相关蛋白的活性,还可以作为信使广泛地参与多种细胞信号转导途径。
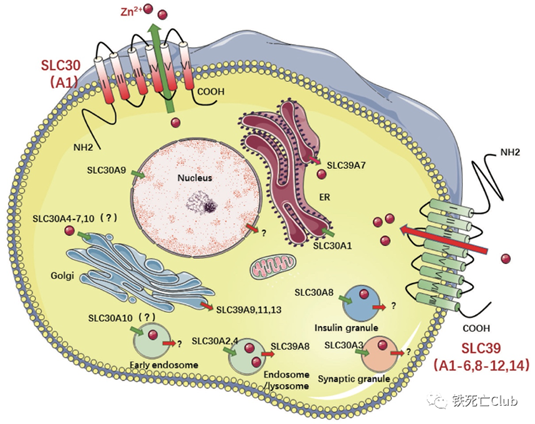
造血干细胞(Hematopoietic stem cells, HSCs) 是血液系统中的干细胞,具有长期自我更新的能力及分化成各类血细胞的潜能,对于维持体内造血稳定至关重要[5, 6]。铁作为重要的微量元素,在造血系统的重要性不言而喻,然而锌离子及其转运蛋白是否参与早期胚胎造血发育,又是通过怎样的机制实现对胚胎早期造血过程的调控?对于这些关键科学问题亟需阐明。
研究人员首先在斑马鱼模式动物中开展低锌筛选实验,发现slc39a10基因会响应低锌而出现转录表达水平上调,并通过显微注射slc39a10 Morpholino(MO)敲降后,观察到胚胎存在严重贫血以及HSPCs数量下降的表型。进一步,利用CRISPR-Cas9技术构建slc39a10斑马鱼突变体以及组织特异性拯救实验确认slc39a10主要对定向造血时期HSPCs生存产生重要影响。
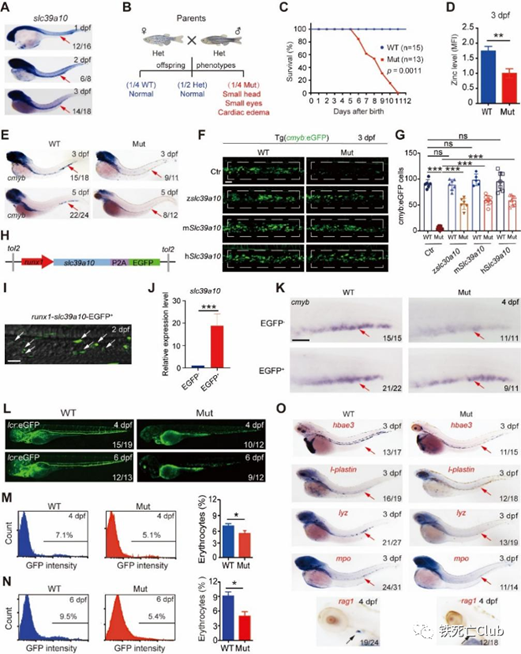
slc39a10突变体斑马鱼定向造血异常
(来自论文 Figure 2)
为进一步在更高等模式动物中验证这一发现,研究人员构建了Slc39a10造血系统特异性敲除小鼠并观察到小鼠出现出生第一天内死亡,并发现多系血细胞严重减少表型。
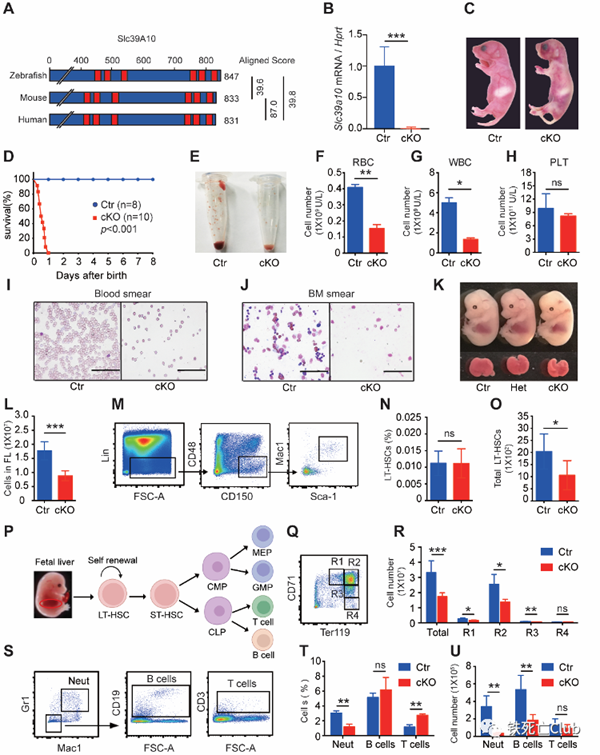
造血系统特异敲除Slc39a10小鼠出生一天内死亡并伴有造血缺失
(来自论文 Figure 4)
在分子机制的探索中,研究人员猜测SLC39A10作为重要的锌离子转运蛋白,是否通过调控HSPCs内锌稳态在其中发挥重要作用。为验证这一猜想,研究人员首先确认了SLC39A10敲除会引起HSPCs内锌水平下降;其次,在体外补充过量锌离子可以部分拯救敲除动物模型的造血缺陷;另外,在低锌刺激下能够诱导野生型斑马鱼及小鼠胚胎HSPC出现与SLC39A10敲除模型中相似的造血缺陷。
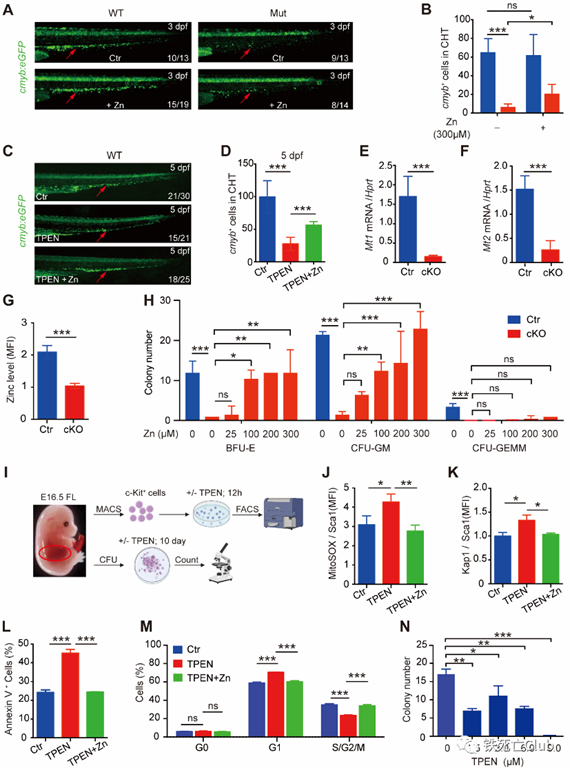
补充锌离子拯救slc39a10缺失引起的造血干细胞损伤
(来自论文 Figure 6)
另一方面,研究人员发现坏死抑制剂Nec-1以及GSK’872体外能够部分挽救SLC39A10敲除引起的HSCs死亡,提示SLC39A10缺失会在HSCs內引起以程序性坏死为主的细胞死亡。
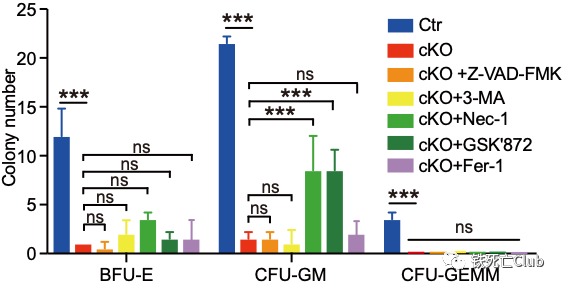
坏死抑制剂可部分挽回slc39a10缺失HSPCs的克隆形成能力
(来自论文 Figure 7)
如下模式图详细描述了该论文重要发现,不仅揭示锌转运蛋白SLC39A10对早期胚胎发育的重要性,同时也阐明了SLC39A10基因缺失诱导造血干细胞锌缺乏最终导致造血干细胞死亡。
浙江大学博士研究生何旭艳、葛朝东以及中国科学院动物所博士研究生夏均为本论文的共同第一作者;闵军霞与王福俤教授为本论文的共同通讯作者;浙江大学医学院徐鹏飞教授参与课题研究。该项目得到国家自然科学基金和国家重点研发计划项目的资助。
专家点评
刘峰 中国科学院动物研究所,研究员,国家杰青
造血干细胞能够自我更新和分化为下游多种血细胞,对于维持机体血液系统的动态平衡具有重要作用。因此,探究造血干细胞的生存及分化调控机制一直是造血领域研究的重点。大量研究表明:造血干细胞的生存异常及其分化失调将严重影响个体生长发育,并导致多种疾病。然而,微量元素稳态调控是否影响造血干细胞的功能及分化仍然存在诸多未解之谜。
铁作为首个明确影响造血的机体必需微量元素,参与血红蛋白的生成、细胞色素及多种酶的合成,促进生长。但迄今为止,除铁离子外,其它微量元素,如锌离子及其稳态代谢与造血的关联文章虽有报道,但其是否在造血干细胞中发挥作用?如何参与并影响造血干细胞的生存及分化过程?这些谜团都亟待解析。
近日,王福俤/闵军霞教授团队利用斑马鱼以及小鼠模型,成功揭示了锌转运蛋白Slc39a10(Zip10)对于造血干细胞生存的至关重要。该研究通过斑马鱼突变体以及造血系统特异性敲除小鼠,系统性研究发现Slc39a10缺失引发造血干细胞死亡,并最终导致胚胎致死的命运。在这一过程中,一方面,锌离子对于造血干细胞的生存发挥重要作用。体外补充锌离子可以挽救Slc39a10缺失引起的造血干细胞死亡表型;另一方面,多种程序性死亡抑制剂中,只有坏死抑制剂能够部分挽救Slc39a10缺失导致的造血异常表型,这些结果表明:Slc39a10缺失通过造血干细胞内锌离子缺乏,进而导致造血干细胞坏死。
总之,本研究率先提出锌离子对于维持造血干细胞的生存及其分化能力具有重要调控作用,为系统理解微量元素调控造血干细胞发育提供了崭新的视角。这一研究成果为造血系统疾病的发病机制研究及其未来治疗提供了潜在理论基础。
蔡露,美国路易斯维尔大学医学院,终身教授,儿科研究所主任,长期从事糖尿病及心血管疾病研究;在锌与人类疾病领域有诸多学术成就
锌离子作为所有生物体所需的微量营养素,不仅是构成蛋白质的结构成分,而且作为多种酶催化的辅助因子,参与调控生物体重要生理过程及发育的各个阶段。锌离子稳态对于维持细胞及个体的生存至关重要。比如锌缺乏与多种疾病发生发展有关,可导致个体生长发育迟缓、免疫系统紊乱、神经系统功能异常、贫血等症状。
细胞内锌稳态主要由两大类锌转运蛋白家族,包括14个SLC39A锌离子细胞内运蛋白及10个SLC30A细胞锌离子外排家族蛋白的精准调控。有报道提示锌离子在多种血细胞,包括巨噬细胞、NK细胞、树突状细胞、T细胞、B细胞、红细胞以及血小板等发生及功能发挥重要作用。然而,锌离子是否会影响造血干细胞及其分化仍是未解之迷。
近日,王福俤/闵军霞教授团队利用斑马鱼及小鼠动物模型,首次发现锌缺乏导致造血异常,进一步聚焦阐明造血干细胞锌转运蛋白SLC39A10介导锌内流的核心地位。该基因在多物种决定造血干细胞的存活以及造血正常运行,并影响机体的发育进程。研究人员通过锌回补以及抑制程序性坏死部分挽救SLC39A10缺失引发的造血异常表型。
综上所述,该研究首次阐明了锌稳态对早期造血系统的重要性,并发现介导造血干细胞锌转运的重要靶点,为孕期补锌的必要性提供了重要支撑以及对锌缺乏导致造血疾病的异常提供新型潜在防治手段。
闵军霞/王福俤教授团队在锌稳态领域代表作:
闵军霞/王福俤团队确认了金属离子转运蛋白SLC39A10(ZIP10)介导巨噬细胞锌离子摄取,并阐明了其在机体炎性状态下发挥作用的深层分子机制,为炎症及败血症等疾病的防治提供了新靶点。该成果也是在国际上通过敲除小鼠模型确认SLC39A10为首个巨噬细胞锌转运蛋白。成果发表在著名学术期刊PNAS;论文题目为:“Metal transporter Slc39a10 regulates susceptibility to inflammatory stimuli by controlling macrophage survival”[7]。本文第一作者为博士研究生高虹(现为武汉大学教授)。
闵军霞/王福俤团队通过对多种糖尿病小鼠模型及胰岛细胞特异敲除小鼠模型的实验研究,首次发现转运蛋白Slc39a5(Zip5)对胰岛β细胞锌离子稳态及胰岛素分泌具有重要调节作用。成果发表在著名学术期刊Protein & Cell;论文题目为:“The zinc transporter Slc39a5 controls glucose sensing and insulin secretion in pancreatic β-cells via Sirt1- and Pgc-1α-mediated regulation of Glut2”[8]。论文第一作者为王鑫慧博士,现为浙江大学医学院副教授。
闵军霞/王福俤团队在新刊MedComm在线发表封面研究论文 “Metal transporter Slc30a1 controls pharyngeal neural crest differentiation via the zinc-Snai2-Jag1 cascade”[9]的研究长文,揭示转运蛋白slc30a1及锌离子在斑马鱼胚胎下颌软骨发育重要功能及其调控机制。论文第一作者为夏梽丹博士,现为浙江大学医学院副教授。
闵军霞/王福俤团队在国际学术期刊Open Biology发表新成果"Slc39a5-mediated zinc homeostasis plays an essential role in venous angiogenesis in zebrafish"[10]。该成果以斑马鱼为模型,在国际上首次揭示了锌离子稳态维持静脉血管网络生成重要作用,为相关疾病诊治提供了科学依据。论文第一作者为夏梽丹博士,现为浙江大学医学院副教授。
闵军霞/王福俤团队在核心期刊《生命科学》发表封面综述“金属转运蛋白SLC39A14生理功能及作用机制研究进展”。该综述深入阐述了SLC39A14(又称为ZIP14)在不同组织器官中转运金属离子的生理功能,以及SLC39A14在离子转运、代谢紊乱疾病中的分子调控机制新成果,并讨论了未来研究方向[11]。
闵军霞/王福俤团队在The American Journal of Clinical Nutrition, AJCN(《美国临床营养学杂志》)发表研究成果“Zinc supplementation improves glycemic control for diabetes prevention and management: A systematic review and meta-analysis of randomized controlled trials”。首次为补锌可用于2型糖尿病和妊娠期糖尿病预防与治疗提供了肯定答案,这一重大成果为糖尿病防控提供了新的视角和策略[12]。论文第一作者为王鑫慧博士,现为浙江大学医学院副教授。
闵军霞/王福俤团队在国际学术期刊European Journal of Cell Biology发表研究成果“Zinc transporter Slc30a1 regulates melanocyte development by interacting with mt2 in zebrafish”。该研究以slc30a1突变体斑马鱼为研究对象,揭示了slc30a1是黑色素细胞的功能蛋白,其缺失会引起黑色素细胞内锌水平升高从而引起其异常增殖,同时mt2在slc30a1介导的黑色素细胞增殖过程中发挥了重要作用[13]。论文第一作者为夏梽丹博士,现为浙江大学医学院副教授。
参考文献
1.Kambe, T., et al., The Physiological, Biochemical, and Molecular Roles of Zinc Transporters in Zinc Homeostasis and Metabolism. Physiol Rev, 2015. 95(3): p. 749-84.
2.Wessels, I., H.J. Fischer, and L. Rink, Dietary and Physiological Effects of Zinc on the Immune System. Annu Rev Nutr, 2021. 41: p. 133-175.
3.Jeong, J. and D.J. Eide, The SLC39 family of zinc transporters. Molecular Aspects of Medicine, 2013. 34(2): p. 612-619.
4.Huang, L. and S. Tepaamorndech, The SLC30 family of zinc transporters - a review of current understanding of their biological and pathophysiological roles. Mol Aspects Med, 2013. 34(2-3): p. 548-60.
5.Orkin, S.H. and L.I. Zon, Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 2008. 132(4): p. 631-44.
6.Dzierzak, E. and A. Bigas, Blood Development: Hematopoietic Stem Cell Dependence and Independence. Cell Stem Cell, 2018. 22(5): p. 639-651.
7.Gao, H., et al., Metal transporter Slc39a10 regulates susceptibility to inflammatory stimuli by controlling macrophage survival. Proc Natl Acad Sci U S A, 2017. 114(49): p. 12940-12945.
8.Wang, X., et al., The zinc transporter Slc39a5 controls glucose sensing and insulin secretion in pancreatic β-cells via Sirt1- and Pgc-1α-mediated regulation of Glut2. Protein Cell, 2019. 10(6): p. 436-449.
9.Xia, Z., et al., Metal transporter Slc30a1 controls pharyngeal neural crest differentiation via the zinc-Snai2-Jag1 cascade. MedComm (2020), 2021. 2(4): p. 778-797.
10.Xia, Z., et al., Slc39a5-mediated zinc homeostasis plays an essential role in venous angiogenesis in zebrafish. Open Biol, 2020. 10(10): p. 200281.
11.周梦瑶, et al., 金属转运蛋白SLC39A14的生理功能及作用机制研究进展. 生命科学, 2020. 032(2020):890-902.
12.Wang, X., et al., Zinc supplementation improves glycemic control for diabetes prevention and management: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr, 2019. 110(1): p. 76-90.
13.Xia, Z., et al., Zinc transporter Slc30a1 regulates melanocyte development by interacting with mt2 in zebrafish. Eur J Cell Biol, 2022. 101(4): p. 151272.


