Cell Death & Differentiation丨陈静海团队发现细胞骨架与线粒体网络结构调控肌细胞分化的新机制
骨骼肌约占动物体重的40%,在保持机体结构和控制运动以及代谢调节等方面发挥着重要作用[1]。骨骼肌的发育和功能稳态高度依赖于包括肌肉细胞分化和肌纤维形成在内的复杂的肌生成过程。骨骼肌运动依赖线粒体供能。线粒体生物合成、在细胞中的分布、形态及功能往往会伴随成肌分化进程而变化[2, 3]。细胞中线粒体的有序排列及其对肌细胞分化的协调作用在骨骼肌发育和维持肌肉功能稳态过程中至关重要。线粒体形态异常或亚细胞定位紊乱往往标志着肌细胞分化异常及肌肉疾病的发生[4]。因此,探索肌细胞中线粒体形态和空间分布模式的建立、协调和维持及其调控机制具有重要的意义。然而,目前现有的研究对负责协调线粒体有序排列与肌发生的途径及其参与的因子仍然不太明确。
2024年8月15日,浙江大学转化医学研究院/浙江大学医学院附属第二医院陈静海研究员团队和西安交通大学生命科学学院丁健教授团队合作在Cell Death & Differentiation杂志上发表了题为Adapting cytoskeleton-mitochondria patterning with myocyte differentiation by promyogenic PRR33的文章。该研究发现PRR33(Proline rich 33)蛋白在骨骼肌中高表达并与细胞骨架蛋白DESMIN结合调控线粒体排列及功能,从而参与调节肌细胞分化进程。

最初,研究者发现PRR33表达水平随肌细胞分化时间增加而增强,提示PRR33可能参与肌细胞分化进程。后续细胞学水平loss-of-function及gain-of-function实验证明PRR33正向调控肌细胞分化。
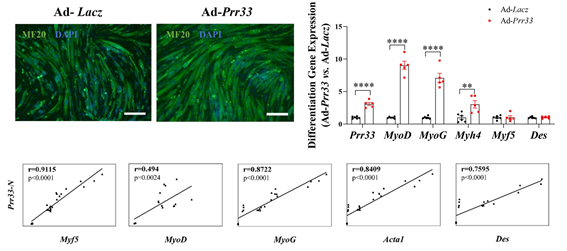
图1 PRR33正向调控肌细胞分化
为了探究PRR33在成体中的功能,研究者构建了骨骼肌特异性敲除PRR33的遗传模型小鼠(Prr33 fl/fl; HSA-Cre)。成体实验证明,PRR33敲除抑制了骨骼肌分化,小鼠肌束横截面积降低,并且小鼠最大抓握力及运动耐力均下降。
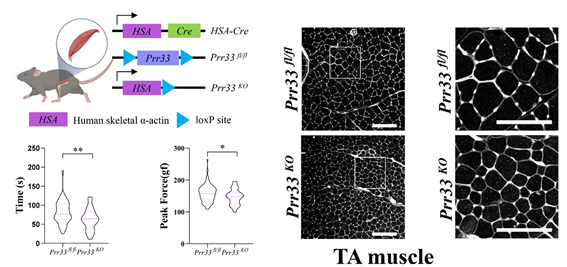
图2 PRR33缺失影响小鼠肌肉功能
PRR33功能缺失性模型的转录组和PRR33邻近蛋白组实验结果暗示,PRR33可能是细胞骨架中间丝结构和线粒体功能的调节因子。肌肉特异性中间丝蛋白DESMIN是调控线粒体亚细胞分布的关键因子。在肌纤维中,DESMIN定位于肌节的Z-disk周围,而线粒体通常与Z-disk相互作用并与肌节相连。线粒体与肌节的相对位置及有序排列对肌细胞及其分化过程中能量的供求协调和平衡至关重要。而这些都非常依赖于线粒体和肌纤维之间的关键连接蛋白DESMIN的作用[5]。
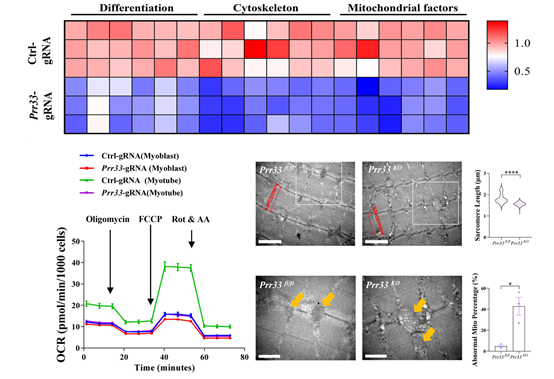
图3 PRR33缺失影响肌肉细胞骨架和线粒体功能
有意思的是,研究者发现PRR33是参与这一调控过程的关键因子。PRR33可以与DESMIN相互作用。 敲降或敲除PRR33会导致DESMIN蛋白聚集,线粒体形态及排列紊乱,进而影响线粒体功能,最终导致肌细胞分化受到抑制。
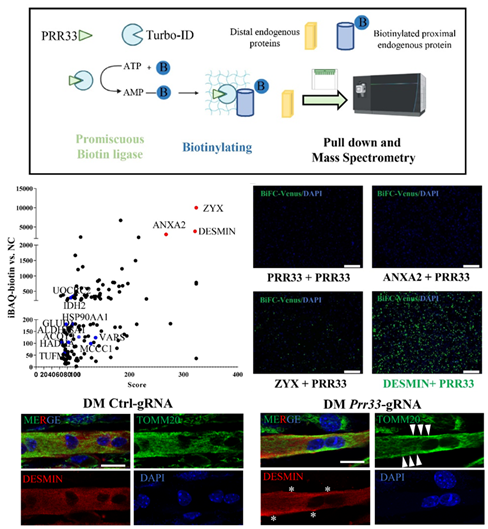
图4临近蛋白组学筛选到PRR33与DESMIN结合
该研究鉴定了一个协调DESMIN介导的骨骼肌线粒体排列的新蛋白PRR33,为阐明线粒体分布与肌肉分化之间的协调机制提供了重要线索与切入点。 同时,PRR33也可能会成为干预肌肉疾病的一个潜在的靶点。
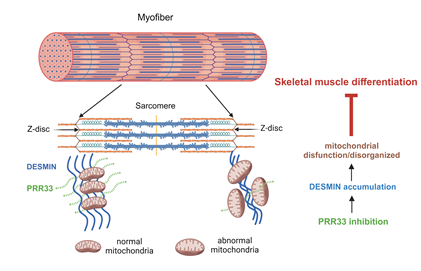
图5 PRR33通过调整DESMIN- Mitochondria排列结构来调控肌细胞分化
浙江大学转化医学研究院博士 付旭阳,张峰,董晓璇 为论文的共同第一作者。浙江大学转化医学研究院/浙江大学医学院附属第二医院陈静海研究员与西安交通大学生命科学学院丁健教授为论文的共同通讯作者。
文章链接:https://www.nature.com/articles/s41418-024-01363-w
References:


