Cell Metabolism丨闵军霞团队合作研究发现“铁死亡信号”新理论
近日,浙江大学转化医学研究院闵军霞教授联合王福俤教授团队合作研究新成果“Adipocyte-derived ferroptotic signaling mitigates obesity”发表在国际优秀学术期刊Cell Metabolism(Q1区,影响因子27.7)。
该科学研究逻辑及创新要点
首次发现肥胖患者和肥胖小鼠脂肪组织铁死亡指标明显下调;
通过激活脂肪细胞铁死亡指标(信号)可显著抵抗高脂饮食诱导的肥胖和系列代谢紊乱,有望成为靶向治疗肥胖新策略;
首次阐明脂肪组织铁死亡调控规律,全球首次提出“铁死亡信号ferroptotic signaling”新理论;
针对铁元素重要科学意义讨论强调了“铁科学Ferrology”新学科。
免费全文下载链接
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00456-X
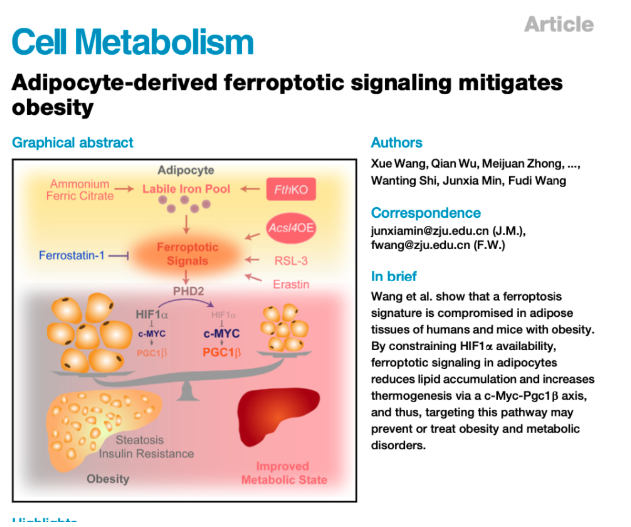
铁死亡信号激活的生理意义/CM论文模式图摘要截图

论文首页部分截图
肥胖是一种由多因素参与的能量代谢紊乱的疾病状态。因肥胖引发的2型糖尿病、心脑血管疾病和癌症等疾病发病率逐年增加且呈年轻化趋势,寻找防治肥胖的有效措施迫在眉睫。脂肪组织是参与调控全身能量代谢的重要器官,研究脂肪稳态在肥胖及其并发症中具有重要意义。铁死亡(Ferroptosis)是一种铁依赖的、脂质过氧化累积为主要特征的细胞死亡形式,参与多种疾病的发生发展进程。目前尚不清楚脂肪细胞能否发生铁死亡及铁死亡是否能调控肥胖的发展进程。
肥胖人群/鼠脂肪组织铁死亡标志物水平下降
通过分析公共RNA seq数据库,研究人员发现肥胖病人和瘦人对照的腹部皮下脂肪组织差异通路包括铁死亡通路和调节铁死亡敏感性的通路(Prostaglandin synthesis and regulation;Fatty acid biosynthesis;Oxidative damage response)。与瘦人健康对照相比,肥胖患者腹部脂肪组织中铁死亡指标4-HNE和MDA免疫组化染色阳性面积显著减少。肥胖鼠脂肪组织铁死亡指标也呈现相同的规律,提示了肥胖人群和肥胖小鼠的脂肪组织中铁死亡特征减弱。
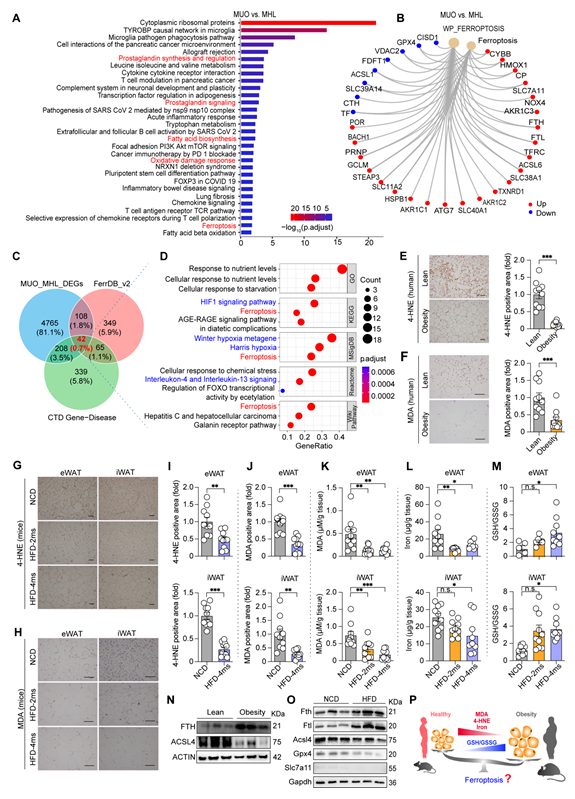
图1: 肥胖患者/鼠脂肪组织铁死亡标志物水平显著下降
激活脂肪细胞铁死亡信号可减少脂质积累
研究人员用非致死剂量(低剂量)的铁死亡激活剂RSL3可明显诱导原代脂肪细胞铁死亡特征(脂质过氧化),而不会导致细胞死亡。因此,将这种处理定义为激活铁死亡信号。激活铁死亡信号导致成脂诱导第7天原代脂肪细胞中脂滴含量减少。研究人员将含有RSL3的羊毛脂涂抹在腹股沟皮下脂肪处的皮肤上,发现增强了皮下脂肪中的铁死亡信号,减缓高脂诱导的肥胖和代谢紊乱。
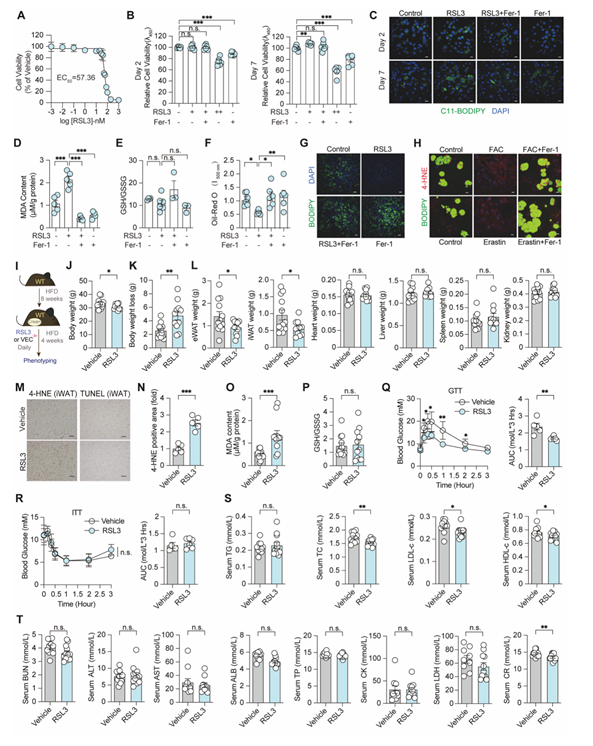
图2:低剂量铁死亡激活剂可显著减少脂质积累
5(S),5(S)-DiHETE诱导铁死亡信号降低Hif1a表达,并继而减少脂质积累
研究人员利用蛋白组分析揭示,RSL3组原代脂肪细胞中促进HIF1羟基化和降解的蛋白Phd2表达水平增加,与之一致的是,RSL3处理组中细胞核部分中Hif1a蛋白水平较低。CoCl2(诱导缺氧)、PHD2抑制剂DMOG或IOX2、慢病毒过表达Hif1α均能逆转RSL3处理导致的原代脂肪细胞脂滴减少表型,提示铁死亡信号通过降低了Hif1a蛋白水平继而抑制脂质积累。构建脂肪细胞特异性敲除Hif1a小鼠(Hif1αKO),发现其抵抗高脂诱导的肥胖和代谢紊乱,与皮肤涂抹RSL3鼠表型一致。进一步明确了铁死亡信号通过降低Hif1a水平以减缓肥胖发生。
然后,研究人员继续探索铁死亡信号如何促进Phd2表达继而降低Hif1a的可用性。铁死亡的发生需要PUFA的氧化,进一步产生有生物活性的氧化脂质。氧化脂质组结果发现,5(S),15(S)-DiHETE的水平在RSL3处理组高于对照组,且5(S),5(S)-DiHETE促进了SVF分化的原代脂肪细胞中Phd2的蛋白表达,降低了Hif1a的蛋白水平。这些结果共同揭示了脂肪细胞中铁死亡信号抑制Hif1a的分子机制,即铁死亡信号促进关键生物活性脂质生成,从而上调Phd2蛋白水平。
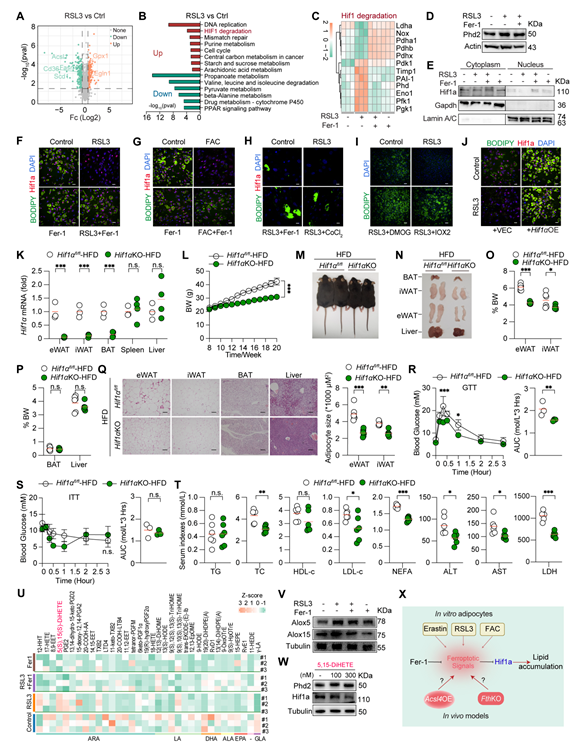
图3:铁死亡信号通过抑制 Hif1a 减少脂肪积累
脂肪细胞特异性Acsl4过表达小鼠抵抗高脂诱导肥胖及代谢紊乱
研究人员继续利用转基因小鼠分别操纵了两个铁死亡途径的关键基因表达,包括脂质过氧化途径(Acsl4)和铁代谢途径(Fth),进一步明确脂肪细胞铁死亡信号的对肥胖的抑制功能。他们发现脂肪细胞特异性过表达Acsl4(Acsl4OE)小鼠脂肪组织MDA含量增加,即脂肪细胞铁死亡信号增强,抵抗高脂引起的肥胖、组织炎症及代谢紊乱。
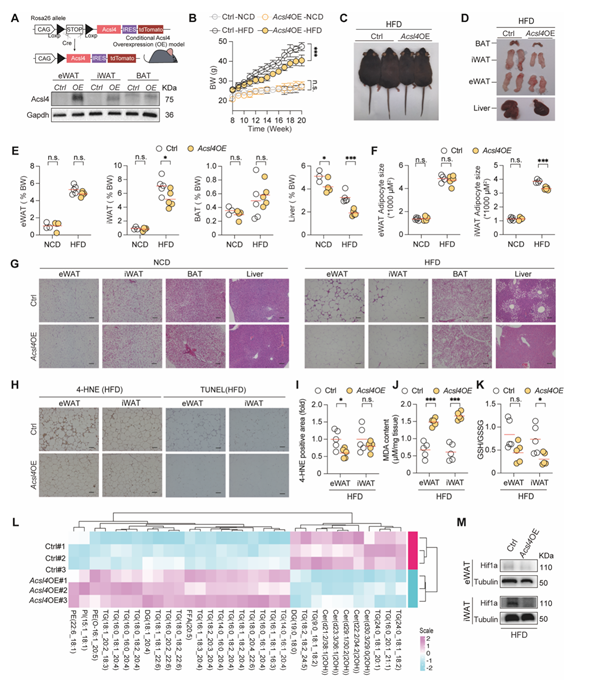
图4:脂肪组织Acsl4过表达激活铁死亡信号抵抗高脂诱发肥胖
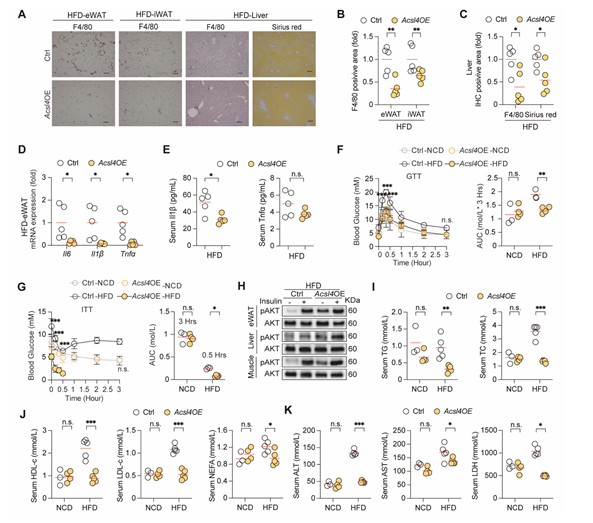
图5:脂肪组织过表达Acsl4显著抵抗肥胖引起的系列代谢紊乱
脂肪细胞特异性敲除Fth小鼠抵抗高脂诱导肥胖及代谢紊乱
同样的,脂肪细胞特异性Fth敲除小鼠(FthKO)小鼠脂肪组织中4-HNE染色阳性面积增多、MDA含量增加,提示铁死亡信号增强。和前文假设一致,高脂喂养的FthKO小鼠脂肪组织中Hif1a蛋白表达降低,进一步确定了铁死亡信号通过降低Hif1a水平以减缓肥胖。
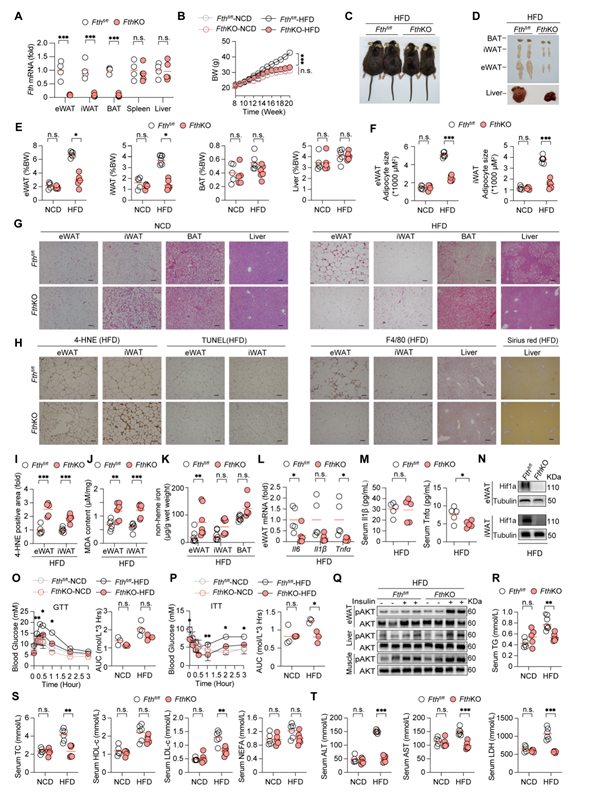
图6:脂肪组织Fth敲除显著抵抗肥胖及系列代谢紊乱
铁死亡信号通过HIF1α-c-Myc-Pgc1β通路促进米色脂肪产热
随后研究人员将高脂喂养1个月的FthKO鼠置于代谢笼中,发现氧气消耗量和能量消耗增加。另一方面,冷刺激状态下,高脂喂养的FthKO小鼠体表温度明显高于对照小鼠,维持体温能力更强,这些结果提示脂肪细胞中的Fth通过抑制适应性产热来减少能量消耗促进肥胖。进一步棕色脂肪及米色脂肪细胞Ucp1检测及耗氧量检测结果表明,铁死亡信号促进米色脂肪产热而非棕色脂肪产热以增加能量消耗。Pgc1β是调控适应性产热和线粒体能量代谢的关键转录因子。研究人员发现铁死亡信号通过靶向Hif1α-c-Myc-PGC1β途径,促进米色脂肪产热,改善高脂模型下的代谢状态。
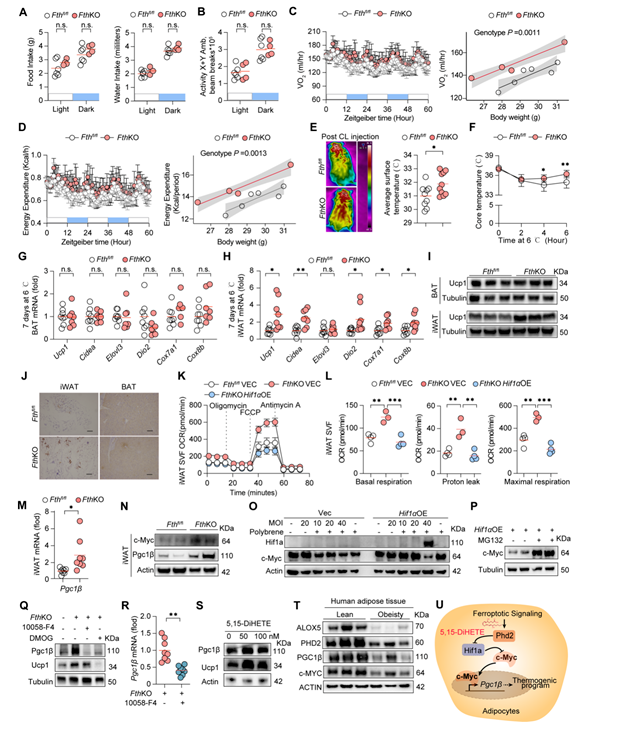
图7:脂肪细胞敲除Fth可显著促进米色脂肪产热
综上,研究人员突破常规,揭示了铁死亡信号通过非细胞死亡的信号通路调控脂肪稳态和系统能量代谢。这为脂肪代谢的深层机制提供了新见解,同时有望帮助开发针对肥胖及相关代谢紊乱的有效治疗方案。
浙江大学医学院博士后王雪博士、浙江大学一带一路国际医学院特聘副研究员吴谦博士为论文共同第一作者。王福俤教授和闵军霞教授为论文共同通讯作者。复旦大学中山医院陈颖和李小英教授为临床研究提供重要支持。本研究得到国家自然科学基金等项目基金资助。

论文第一作者王雪博士(左一)、共一作者吴谦博士(右一)、共同通讯作者闵军霞教授(右二)及王福俤教授(左二)
文献出处
Xue Wang 王雪 #,Qian Wu 吴谦)#,Meijuan Zhong, Ying Chen, Yudi Wang, Xin Li, Wenxi Zhao, Chaodong Ge, Xinhui Wang, Yingying Yu, Sisi Yang, Tianyi Wang,∙ Enjun Xie, Wanting Shi, Junxia Min 闵军霞*, Fudi Wang 王福俤*. Adipocyte-derived ferroptotic signaling mitigates obesity. Cell Metabolism, 2024, December 26, https://doi.org/ 10.1016/j.cmet.2024.11.010


