Cell Reports︱刘鹏渊/陆燕团队揭示泛癌tRNA来源片段CAT1促进肿瘤发生发展的新机制
tRNA来源的片段(tRNA-derived fragment, tRF)是一类新发现的非编码小RNA,越来越多的研究证实内源性tRF是具有生物学功能的分子,而不是tRNA的随机降解产物,实际上它是由一套高度保守和精确的位点特异性切割机制所控制产生的长度为14-50个核苷酸的转录本。根据在tRNA前体和成熟tRNA上的切割位点可以将tRF大致分为3大类,包括:(1)来源于成熟tRNA的5’-或3’-末端的5’-tRF和3’-tRF(长度为14-30 nt);(2)由应激诱导的来源于成熟tRNA的5’-或3’-末端的5’-tiRNA和3’-tiRNA(长度>30 nt);(3)来源于tRNA前体的1-tRF。近年来的研究表明,tRF参与了各种各样的分子和生理过程。一方面,tRF可以在转录水平调控基因的表达,如RNA沉默;另一方面,tRF也可以通过转录后水平的调控来影响基因的表达,如翻译调控和表观遗传学调控[1,2]。研究发现tRF在各种类型癌症中频繁出现表达失调,并且一些tRF的异常表达在功能上直接参与了癌症的发生和发展。例如,一些缺氧应激诱导的tRF可以与致癌RNA结合蛋白YBX1结合,导致多个致癌转录本的稳定性降低,从而抑制了乳腺癌的转移。相反,5’-tRFCys可通过驱动核仁蛋白与特定的转移相关mRNA发生寡聚化来促进其稳定,以此发挥促进乳腺癌转移的作用[2,3]。然而,目前tRF在肿瘤发生发展中的生物学功能研究仍有很大的知识空白,tRF能否通过调控关键致癌蛋白发挥促肿瘤作用尚不清楚,tRF能否作为体液生物标志物和临床治疗靶点也存在很大的未知性。
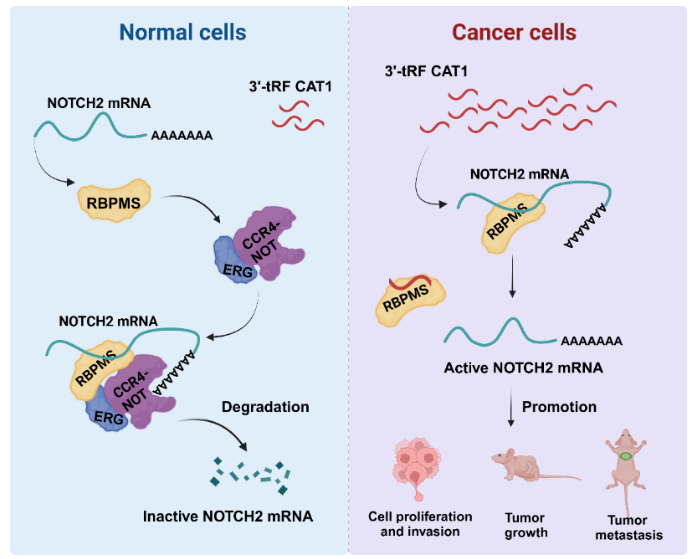
2023年11月8日,浙江大学转化医学研究院刘鹏渊、陆燕团队与吕志民教授合作在Cell Reports杂志上在线发表题为“Pan-cancer tRNA-derived fragment CAT1 coordinates RBPMS to stabilize NOTCH2 mRNA to promote tumorigenesis”的文章,新发现了一种泛癌3’-tRF——其命名为癌症相关tRF1(cancer associated tRF 1,CAT1)——在多种肿瘤组织中的表达均异常上调,并且其高表达与多种类型癌症患者的不良生存预后呈正相关。以肺癌为研究对象,体内和体外实验均证实CAT1可以促进肺癌细胞的增殖和转移,并揭示了CAT1通过与RBPMS蛋白相互作用来影响NOTCH2信号,从而促进肺癌发生发展的分子机制,由此提示CAT1作为非侵入性癌症诊断和治疗策略具有巨大潜力。 为了探究tRF与肿瘤的整体关系,本文研究人员前期的研究系统地分析了TCGA数据库中12种肿瘤类型中的tRF表达谱,发现了11种tRF在大多数肿瘤中显著上调,且与预后不良高度相关。其中一个来源于tRNA-Ala-AGC-1-1 3’-末端的长度为18个碱基的3’-tRF——研究人员将其命名为“癌症相关候选tRF1(cancer associated tRF 1,CAT1)”——被发现在多种肿瘤组织中的表达均上调,并且其高表达与多种类型癌症患者的不良生存预后呈正相关,包括肺癌。为了验证分析结果的真实性,研究人员首先改良了一种基于TaqMan qPCR 的检测方法——Db-PCR,其可以精确分辨tRF 末端单个核苷酸差异。利用该方法,研究人员分析了医院组织库中多种肿瘤样本中的CAT1表达,与对TCGA 数据库中的小RNA测序数据的分析结果一致,证实了CAT1在大多数癌症类型中的表达显著上调,提示CAT1可能作为大多数癌症发病机制的超级驱动因子。 以肺癌为研究对象,本文研究人员发现,CAT1不仅在肺癌组织(包括肺腺癌LUAD和肺鳞癌LUSC)中显著高表达,而且其高表达与肺癌不良预后密切相关,尤其是LUAD,而且利用Db-PCR对LUAD患者和非癌症对照人群的血浆样本进行独立对比也显示LUAD患者血浆中CAT1的表达明显高于对照。进一步地,通过体外细胞实验和体内动物实验,研究人员证实,CAT1是肺癌发病机制中的致癌调节因子,其可以通过调节细胞周期和EMT进程促进肿瘤细胞的增殖和转移。 随后,研究人员对CAT1在肺癌细胞中的潜在分子机制进行了深入探索。结合RNA-Pull Down和RNA免疫共沉淀(RIP)实验发现,具有多重剪接的RNA结合蛋白(RBPMS)中的RNA识别基序(RRM)结构域可以识别CAT1中的CAC RNA识别元件(RRE),从而介导了两者之间的相互作用。RBPMS是含有单一RRM的RNA结合蛋白,通过优先结合含有CAC RRE的RNA从而在基因的转录后调控中发挥重要作用,参与了RNA加工、稳定、运输等多种过程。通过分析比较CAT1敲低的RNA-seq数据、RBPMS敲除的RNA-seq数据以及RBPMS-RIP-seq数据中的差异表达基因,并与包含CAC RRE识别元件的基因进行交集,再经过qPCR 验证,研究人员发现CAT1可以影响与RBPMS结合的CAC RRE靶点的表达。深入研究发现,在肺癌细胞中过表达的CAT1可以与NOTCH2 mRNA竞争性地结合RBPMS,抑制了NOTCH2 mRNA与RBPMS的结合,进而抑制了随后的CCR4-NOT 脱腺苷复合物介导的NOTCH2 mRNA的降解。最终,CAT1介导的NOTCH2 稳定性以及表达量的增加促进了肺癌细胞的细胞周期进程、增殖、迁移和侵袭,促进了肺癌的发生和发展。 综上所述,本研究提出了一种新的肺癌发生发展的分子机制,即内源性3’-tRF CAT1与RBPMS蛋白的结合促进NOTCH2 mRNA的释放(图1),从而导致NOTCH2在肺癌中的稳定和激活,由此揭示了肿瘤特异性过表达的tRF与癌症进展之间的内在联系,揭示了先前未知的由泛癌tRF CAT1介导的癌症中NOTCH信号的关键调节机制,同时强调了CAT1 作为一种新的无创诊断标志物和治疗靶点的临床潜力。 图一 浙江大学附属妇产科医院博士后余梦倩、浙江大学附属邵逸夫医院博士后易佳妮和浙江大学附属妇产科医院助理研究员邱琼姿是本文的共同第一作者。浙江大学转化医学研究院/附属邵逸夫医院的刘鹏渊教授、浙江大学转化医学研究院/附属妇产科医院的陆燕教授和浙江大学转化医学研究院/附属第一医院的吕志民教授是本文的共同通讯作者。本研究受到国家自然科学基金、省重点研发计划和中国博士后基金等科研经费支持。 原文链接:https://doi.org/10.1016/j.celrep.2023.113408 刘鹏渊团队、陆燕团队现招聘助理研究员及博士后,详情可见: http://bioinformatics.zju.edu.cn/lotbag/Contacts.html 参考文献 1.Kumar, P., Kuscu, C. & Dutta, A. Biogenesis and Function of Transfer RNA-Related Fragments (tRFs). Trends Biochem Sci 41, 679-689 (2016). 2.Yu, M., Lu, B., Zhang, J., Ding, J., Liu, P., and Lu, Y. tRNA-derived RNA fragments in cancer: current status and future perspectives. J Hematol Oncol 13, 121 (2020). 3.Sun, X., Yang, J., Yu, M., Yao, D., Zhou, L., Li, X., Qiu, Q., Lin, W., Lu, B., Chen, E., et al. Global identification and characterization of tRNA-derived RNA fragment landscapes across human cancers. NAR Cancer 2 (2020).