Nat Cell Biol丨许大千/吕志民团队揭示致癌信号打断生物钟昼夜节律并促进核酸合成的重要机制
生物钟是生命活动的时序控制器,维系了器官组织和细胞水平的生命活动的有序协同,并呈现明显的昼夜节律。生物钟的紊乱与包括癌症在内的多种疾病的发生发展密切相关。2017年Jeffrey C. Hall,Michael Rosbash和Michael W. Young因发现昼夜节律在生理和疾病中的重要作用而获得诺贝尔生理学或医学奖。
越来越多的证据表明:和正常组织相比,肿瘤组织中的生物钟功能及生物钟所调控的下游基因的表达存在明显差异。然而,生长因子受体激活所引发的促癌信号是否直接参与生物钟的调节仍不明确。
2023年1月16日,浙江大学转化医学院/浙江大学医学院附属第一医院/国家基础科学中心许大千/吕志民团队在Nature Cell Biology杂志上发表了题为Nucleus-exported CLOCK acetylates PRPS to promote de novo nucleotide synthesis and tumor growth的研究论文,揭示了生长因子受体激活阻断了转录因子CLOCK的生物钟调控功能,并赋予其调节核酸合成的重要作用。

哺乳动物的生物钟在分子水平上由延迟转录-翻译反馈回路(time-delayed transcription-translation feedback loop, TTFL)构成:在正常细胞中,白天CLOCK与BMAL1结合形成异二聚体,作为正向调控元件结合到E-BOX上,促进下游靶基因(包括Per和Cry)的转录;在晚上,PER与CRY在胞质中累积形成PER/CRY异二聚体,达到一定阈值浓度后可转移至细胞核,反向抑制CLOCK/BMAL1的活性,因此形成了昼夜节律基因转录的规律性调节。然而,肿瘤细胞中生长因子受体激活是否影响昼夜节律生物钟调节尚不清楚。
许大千/吕志民团队发现在肝癌细胞中胰岛素样生长因子1受体(IGF1R)激活的情况下,CK2能够磷酸化CLOCK S106位点,促使CLOCK/BMAL1复合物的解聚,从而抑制了它们所调控的下游靶基因的转录,打断了生物钟的昼夜规律性调节。与此同时,CLOCK被磷酸化后构象发生改变,暴露其出核信号序列(nuclear export signal,NES),使一部分CLOCK由细胞核转移到细胞质。出核后的CLOCK可以发挥蛋白乙酰转移酶的非经典功能乙酰化核酸合成的限速酶PRPS1/2的K29,该位点的乙酰化抑制了原本由HSC70介导的PRPS1/2溶酶体途径的降解,提高了PRPS1/2的蛋白稳定性,加快了肝癌细胞核酸的从头合成速率,进而促进了肝癌的发生发展。
本研究阐明了肿瘤细胞中致癌信号通过干扰CLOCK-BMAL1复合体的形成打断生物钟昼夜规律性调节的分子机制;发现了CLOCK由经典的转录因子功能向非经典的蛋白乙酰转移酶功能转换的分子开关;揭示了肿瘤细胞生物钟的紊乱与DNA/RNA合成之间的相互关系与机制关联,为靶向肿瘤生物钟的紊乱与核酸代谢异常的抗肿瘤药物研发奠定了理论基础。
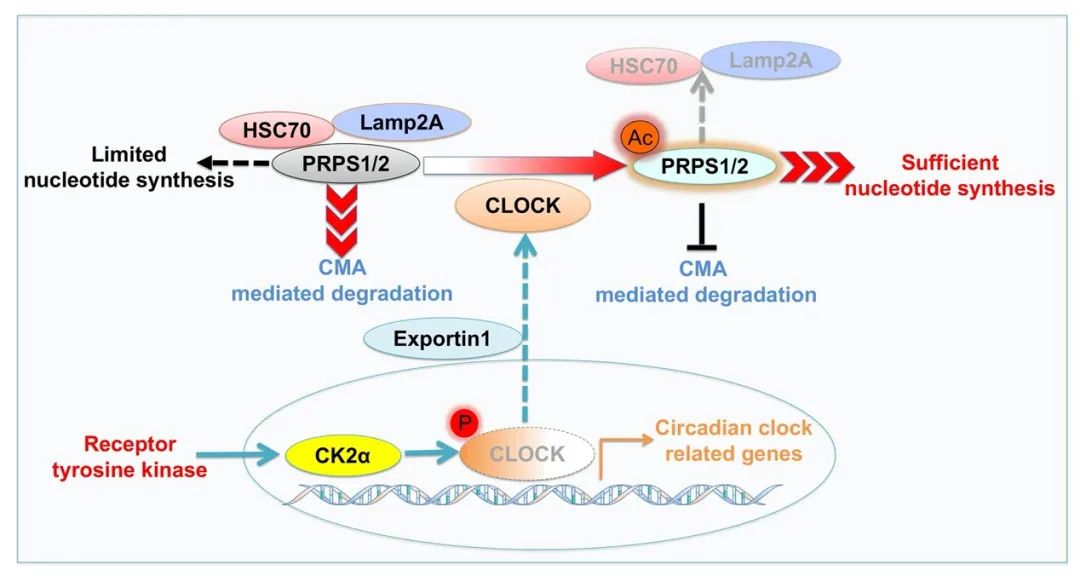
图1. 肿瘤细胞生物钟紊乱与核酸合成的相互关系与调控机制


