Dev Cell | 孙毅团队揭示UBE2F-CRL5ASB11-DIRAS2轴在在胰腺癌的发生发展中的机制
胰腺癌是消化道常见的恶性肿瘤之一。其中,胰腺导管腺癌 (Pancreatic ductal adenocarcinoma, PDAC)是最常见的病理类型。据2020年国家癌症中心报告显示,胰腺癌在恶性肿瘤发病率中排名第8位,死亡率排名第6位【1】。由于其发病过程隐匿、早期诊断困难、进展速度快,同时缺乏有效的治疗手段,患者的预后极差。研究表明,胰腺癌的发生发展与关键基因的异常改变密切相关。超过90%的胰腺癌患者具有致癌KRAS突变【2】。抑癌基因CDKN2A、TP53、SMAD4等的缺失突变与KRAS的活化发生协同作用,促进胰腺癌的发生发展【3】。因此,深入研究胰腺癌发生发展的分子机制具有重要的理论意义和临床价值。
近年来, 许多研究发现蛋白质的拟素化修饰通路在多种肿瘤中被过度激活,并促进肿瘤的发生、发展和转移。拟素化耦联酶UBE2F 与连接酶SAG协同作用,导致CUL5发生拟素化修饰,从而激活Cullin-RING ligase 5 (CRL5)泛素连接酶的活性,促进底物蛋白泛素化降解【4,5】。前期研究发现SAG在胰腺癌组织过表达并与患者不良预后正相关【6】。此外,在基因工程小鼠的胰腺癌组织中,Sag条件性敲除后抑制了KrasG12D驱动的mPanIN和PDAC的形成【7】。这些研究结果提示UBE2F-SAG-CUL5轴可能在胰腺癌的发生发展中起推动作用,但其具体的分子机制尚不清楚。
DIRAS2是DIRAS家族成员之一,与RAS家族基因不同,DIRAS家族成员的GTP酶活性较低,且主要以GTP结合形式存在,它们无法与RAF的RAS结合域相互作用,也不能激活MAPK信号通路【8,9】。目前尚不清楚DIRAS2是否以及如何调控携带KRAS突变的胰腺癌细胞的生长和增殖,以及与KrasG12D诱导的胰腺肿瘤的发生发展有何关联。
2024年4月3日,浙江大学转化医学研究院/浙江大学医学院附属第二医院肿瘤研究所孙毅教授团队在Developmental Cell杂志上发表了题为The UBE2F-CRL5ASB11-DIRAS2 axis is an oncogene and tumor suppressor cascade in pancreatic cancer cells的研究论文【10】,揭示了UBE2F-CRL5ASB11-DIRAS2轴在在胰腺癌的发生发展中的机制。

该研究发现在小鼠KrasG12D诱导的PDAC模型中,Ube2f的敲除抑制cerulein(一种胆囊收缩素)诱导的胰腺炎,并显著延缓了胰腺腺泡细胞导管化及转变为胰腺上皮内瘤变的进程。分子机制研究发现,UBE2F与SAG共同作用激活CRL5 E3连接酶,CRL5通过底物识别成员ASB11募集新的底物蛋白DIRAS2, 促进其泛素化修饰和降解,从而激活下游的MAPK/C-MYC信号通路,促进胰腺肿瘤的发生和发展。体内外敲除实验表明:DIRAS2是一个胰腺癌的抑制蛋白,同时敲除DIRAS2在很大程度上可以消除Ube2f敲除导致的肿瘤生长抑制作用。因此,UBE2F在KrasG12D诱导的胰腺癌中发挥促癌作用是基于对抑癌蛋白DIRAS2的泛素化降解。该研究明确了在小鼠KrasG12D 的PDAC模型中,UBE2F或DIRAS2分别发挥促进肿瘤或抑制肿瘤发生发展的作用。最后,课题组用胰腺癌组织芯片进行免疫组化染色及生存分析,发现UBE2F和DIRAS2的过表达分别于与胰腺癌患者的不良预后呈正负相关。
总之,该研究通过体外实验及小鼠体内实验证明了Ube2f是KrasG12D诱导的胰腺肿瘤发生过程中的重要协同基因:在KrasG12D诱导的胰腺肿瘤发生过程中,Ube2f与Sag共同激活泛素连接酶Crl5Asb11,募集并泛素化降解抑癌底物蛋白Diras2,进而激活下游Mapk/c-Myc信号通路,促进胰腺肿瘤的发生发展。因此,UBE2F-CRL5ASB11-DIRAS2轴有望成为PDAC的有效靶标,而UBE2F和DIRAS2的水平可望成为PDAC患者的预后指标。
本文第一作者为华中科技大学附属协和医院肿瘤中心主治医师昌喻,浙江大学转化医学研究院博士生陈乾为共同第一作者。浙江大学医学院附属第二医院肿瘤研究所和浙江大学转化医学研究院孙毅教授为本文的通讯作者。
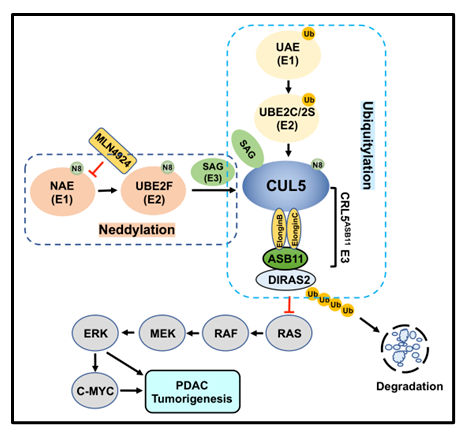
图1: 研究机制模式图原文链接:https://doi.org/10.1016/j.devcel.2024.03.018
参考文献
1. Qiu H, Cao S, & Xu R (2021) Cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020. Cancer Commun (Lond) 41(10):1037-1048.
2. Anonymous (2017) Integrated Genomic Characterization of Pancreatic Ductal Adenocarcinoma. Cancer Cell 32(2):185-203.e113.
3. Hezel AF, Kimmelman AC, Stanger BZ, Bardeesy N, & Depinho RA (2006) Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev 20(10):1218-1249.
4. Zhang S, Yu, Q., Li, Z., Zhao, Y., Sun, Y. (2024) Protein neddylation and its role in health and diseases. Signal transduction and targeted therapy in press.
5. Zhao Y, Xiong X, & Sun Y (2020) Cullin-RING Ligase 5: Functional characterization and its role in human cancers. Semin Cancer Biol.
6. Zhang Q, et al. (2020) Transgenic expression of Sag/Rbx2 E3 causes early stage tumor promotion, late stage cytogenesis and acinar loss in the Kras-PDAC model. Neoplasia 22(6):242-252.
7. Tan M, et al. (2022) The Sag-Shoc2 axis regulates conversion of mPanINs to cystic lesions in Kras pancreatic tumor model. Cell Rep 41(12):111837.
8. Kontani K, et al. (2002) Di-Ras, a distinct subgroup of ras family GTPases with unique biochemical properties. J Biol Chem 277(43):41070-41078.
9. Li X, Liu S, Fang X, He C, & Hu X (2019) The mechanisms of DIRAS family members in role of tumor suppressor. J Cell Physiol 234(5):5564-5577.
10. Chang Y, Chen, Q., Li, H., Xu, J., Tan, M., Xiong, X. and Sun, Y. (2024) The UBE2F-CRL5ASB11-DIRAS2 axis is an oncogene and tumor suppressor cascade in pancreatic cancer cells. Dev Cell In press.


