EMBO J | 许大千/吕志民团队发现E3泛素连接酶VHL具有抑制细胞自噬的新功能
作为最常见的泌尿系统恶性肿瘤之一,肾透明细胞癌 (ccRCC) 占所有肾癌的85%,其重要的生物学特征是抑癌基因VHL的缺失或失活。VHL 蛋白与Elongin B, Elongin C, Cul2 和 Rbx1形成E3 酶复合体。正常环境下,低氧诱导因子α(如HIF1α, HIF2α等)被脯氨酰羟化酶 (PHD1, PHD2, PHD3)羟基化,进一步被VHL识别并泛素化降解。在缺氧条件下或VHL失活的肿瘤中,HIF2α羟基化以及泛素化降解被抑制,导致血管内皮生长因子(VEGF)等一系列肿瘤相关基因的表达,促进肿瘤的发展和转移。基于上述工作,三位科学家William Kaelin, Gregg Semenza 和 Peter Ratcliffe获得了2019年诺贝尔生理学或医学奖。
目前,HIF及其靶点基因VEGF的抑制剂均被广泛应用于肾透明细胞癌的治疗,但在大多数病人中都存在抗药性问题。因此,发现新的VHL底物及针对性的治疗方法,对于肾透明细胞癌的靶向治疗具有重要意义。
2024年2月17日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心的许大千研究员/吕志民教授团队在The EMBO Journal杂志上发表题为 VHL suppresses autophagy and tumor growth through PHD1-dependent Beclin1 hydroxylation 的研究论文,本研究发现,VHL具有与E3泛素连接酶活性不相关的非经典功能,抑制营养应激诱导的自噬。自噬核心调控蛋白 Beclin1 的P54位点在脯氨酰羟化酶PHD1的催化下发生羟基化后,可以与VHL相互作用。进一步的实验表明,VHL并不能促进Beclin1的泛素化降解,而是通过与ATG14L竞争性结合Beclin1,进而抑制Beclin1-VPS34复合体的活性、PI(3)P的产生、及细胞自噬。Beclin1 P54A突变体的表达不仅可以阻断VHL和Beclin1的相互作用及VHL所抑制的细胞自噬,而且能够显著消除VHL对肿瘤的抑制作用。在表达野生型VHL的ccRCC标本中,Beclin1 P54羟基化水平与细胞自噬水平呈负相关,患者预后较差。重要的是,Beclin1-VPS34复合体抑制剂SAR405联合HIF2抑制剂PT2385 对抑制ccRCC的发生发展有良好的协同效应。

该研究发现了E3泛素连接酶VHL可以发挥降解途径非依赖的非经典功能,阐明了肾癌细胞代谢重塑与自噬调控之间的机制耦联及功能效应,加深了对肿瘤特异性自噬时空调控规律的认知;阐明了A TG14L 相关的三型 PI3K 复合体在肾透明细胞癌中的组装特征及细胞自噬调控异质性,为肾癌的治疗提供新的思路和干预方案;从抑癌基因VHL非经典功能的角度,解析了肿瘤细胞自噬异常活化的调节机制,为靶向细胞自噬的肾癌药物研发奠定了理论基础。
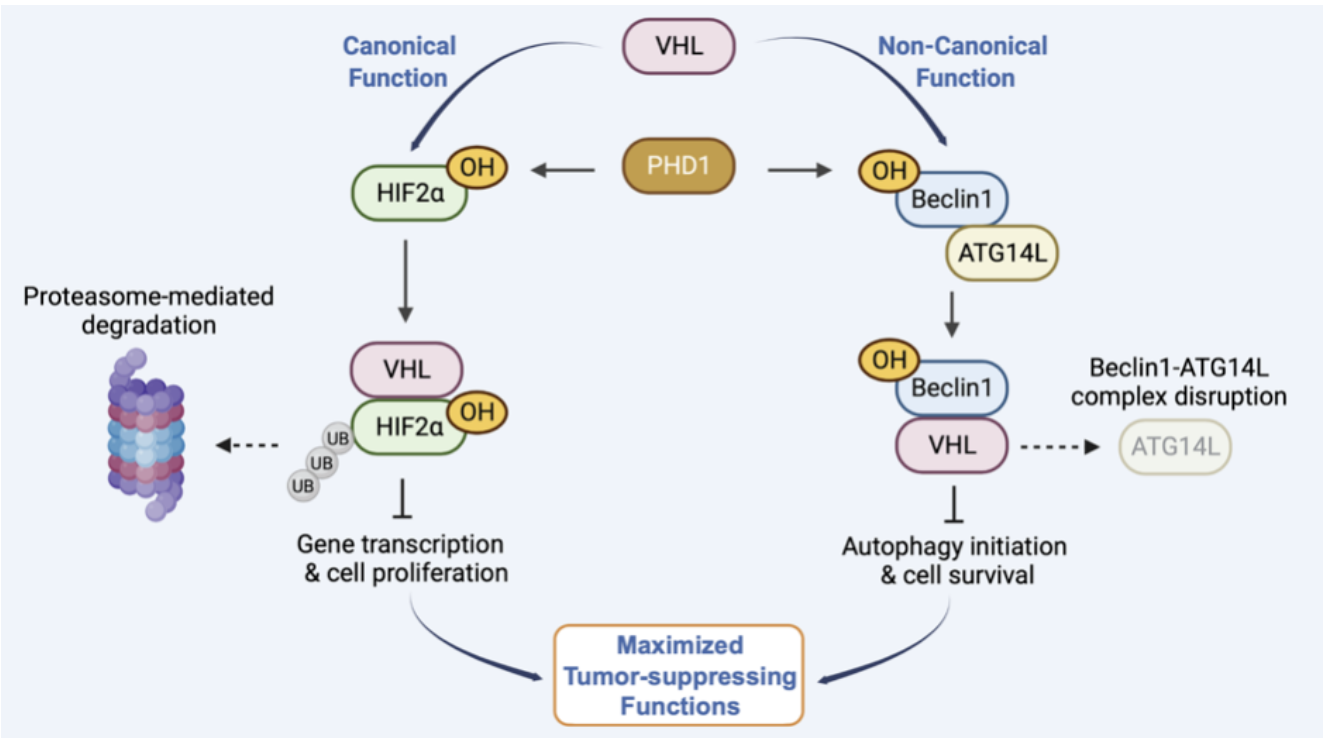
E3泛素连接酶VHL通过发挥降解途径非依赖的非经典功能以抑制细胞自噬
原文链接:https://doi.org/10.1038/s44318-024-00051-2


