Immunity丨史鹏团队发现小胶质细胞介导血流动力学紊乱影响交感神经张力的新机制
随着工业革命后人类生活状态的极大改变,部分进化上应对既往威胁的适应性解剖特点和生理反应不再被迫切需要,反而成为现代慢性病(如高血压、肥胖、糖尿病)的危险因素。高血压作为全球范围内成年人发病率最高的“流行病”(我国35-70岁群中的发病率高达30%以上)1,是致死性心脑血管疾病(如心梗、心衰和脑卒中)的首要独立危险因素,同时也是触发认知功能障碍的重要推手,被冠以“沉默杀手”的称号。绝大多数原发性高血压患者均伴有继发性交感高张,后者进一步推动血压的升高,造成恶性循环。尽管有着耳熟能详的危害,但导致高血压下交感活性继发性高张的机制一直以来并不明确。
血压作为人体主要生命体征,通过推动血液循环为维持生理稳态以及应激状态下的机体功能保驾护航;其本质是血液在血管内流动对管壁产生的压力。为高效配置有限血容量(~5升/60公斤体重成年人)在机体内的流动,动脉系统的收缩/舒张对不同组织脏器的灌注起着关键的调节作用,进而影响血压。神经内分泌因素决定了动脉血管的收缩状态,尤其是持续存在的交感神经张力,对血管平滑肌收缩状态起决定性作用;同时也决定了系统血压。
2024年8月7日,浙江大学转化医学研究院/浙江大学医学院附属第二医院心内科院史鹏课题组,联合浙江医院神经内科刘小利主任医师团队在Immunity杂志在线发表题为“Microglia in the hypothalamic paraventricular nucleus sense hemodynamic disturbance and promote sympathetic excitation in hypertension”的论文,阐明了高血压早期触发交感神经继发性高张的亚解剖、细胞和分子机制。该研究是史鹏课题组继2022年发文揭示正常生理情况下小胶质细胞通过旁分泌作用调控交感神经元兴奋性,维持交感张力和血压稳态2后对疾病的进一步解析。

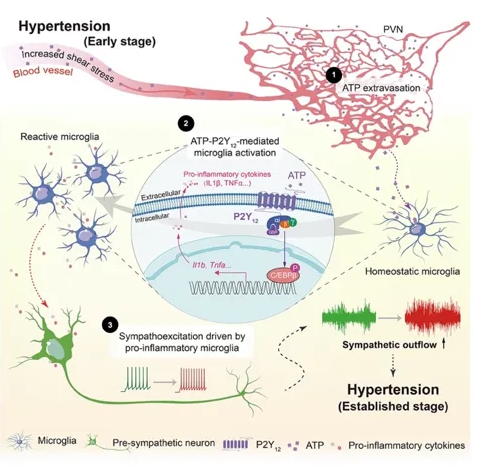
图 1.小胶质细胞感知高血压早期血源性 ATP,进而上调交感神经张力和维持血压攀升的研究模式图。

图2.(Immunity 封面图片候选)小胶质细胞感知外周危险信号并将其传递给神经元,这一过程如“蝴嫌效应”般被级联放大。
通过综合分析两种机制不同药物诱导的高血压动物模型和对多脑区的系统性分析,该项研究发现相较于其它脑区,在交感神经兴奋之前发生了小胶质细胞在下丘脑室旁核(PVN)脑区的聚集和激活现象,提示免疫因素参与了交感神经的继发性升高,这与之前史鹏团队发现的高血压下去除激活态小胶质细胞能够有效减缓血压持续攀升3相一致。进化上,PVN是调控交感神经输出以及神经内分泌功能的保守核团,那么又是何种因素造成PVN区小胶质细胞的特异性激活?
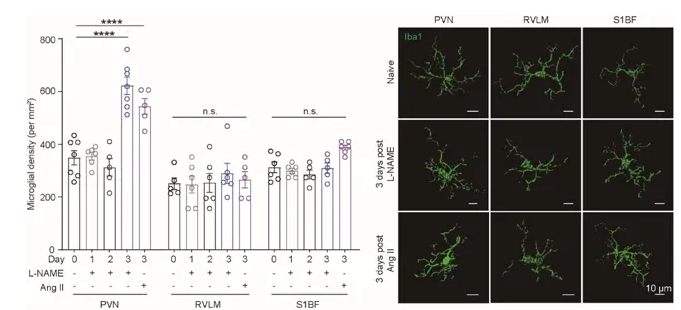
图3.高血压早期小胶质细胞的密度(左)和形态(右)在不同脑区中的差异性。
浙江大学医学院沈啸课题组2019年发表的研究发现:外周血中ATP浓度升高是高血压发生后较早的血生化变化之一4。基于动脉收缩造成的血压升高,以高剪切力为代表的血流动力学紊乱引起红细胞或血管内皮细胞膜孔道蛋白开放(如pannexin)释放ATP,引起血浆浓度升高。此时的ATP不再作为能量“货币”分子,而成为“危险信号分子”起到激活免疫系统的作用。表达在免疫细胞上的嘌呤类受体响应细胞外ATP,引起免疫细胞趋化/激活等一系列效应。嘌呤能受体P2Y12在中枢神经系统中主要高表达在小胶质细胞。本项研究发现药理学降解脑实质游离ATP、阻断P2Y12和特异性敲除小胶质细胞中P2Y12均可以缓解高血压早期小胶质细胞在PVN中的聚集,同时解除PVN前交感神经元兴奋性升高,阻断高血压的进程。分子机制层面,通过对高血压前后下丘脑区小胶质细胞转录本差异性比较并结合体内外实验验证,明确了转录因子C/EBPβ在介导高血压下小胶质细胞激活和通过炎症介质影响PVN区前交感神经元中的作用。至此,该研究明确了高血压早期血源性ATP通过P2Y12-C/EBPβ通路造成小胶质细胞的激活,进而引起PVN交感神经元亢进的过程。
在对高血压早期多脑区的分析中发现:不同脑区中小胶质细胞聚集和激活并不一致,这与不同脑区内游离ATP差异水平相呼应;这一现象引起了团队极大的好奇和不解。脑内85%以上的血管为毛细血管。为何PVN区会有更多游离ATP富集?通过对多脑区血管分布以及拓扑结构的细致比较,团队发现PVN区的血管具有密度最高、直径最细、分支程度最高且弯曲度最大的特点。这一独特的血管拓扑特点很可能使得该脑区对血压改变更为敏感,同时也使得血源性小分子如ATP在该脑区向脑实质浸润最为充分。为进一步在功能上验证这一假说,联合浙江大学生物医学工程与仪器科学学院赵立研究员课题组,该研究对小鼠多脑区的脑血流进行了核磁共振分析,发现血压升高对PVN区血流灌注改变最显著,灌流量会显著地升高,这一结果进一步证实了PVN脑区对脑血流动力改变的高敏感性。PVN是调控血压和血容量的重要核团,而PVN对血流动力改变的高敏感性使得该核团能够对血流动力学紊乱做出快速响应以调节整体循环。既往的研究曾揭示了脑内血管分布的差异5,但该项研究首次将局部脑区的血管形态和拓扑特点与核团的具体功能联系在了一起。
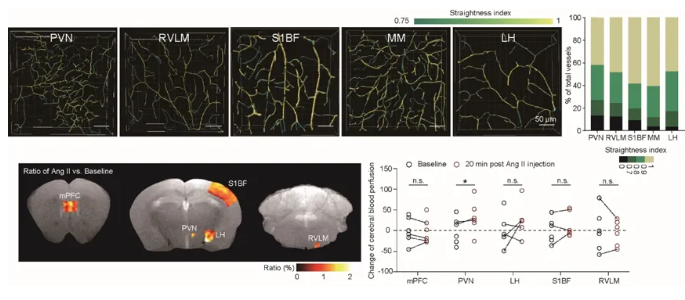
图4.比较不同脑区血管弯曲程度(上)和一过性血压升高造成血流灌注(下)差异。
本研究由浙江大学博士生魏博和博士后程果共同完成;获得国家自然科学基金委、浙江省自然科学基金委、经血管植入器械全国重点实验室、浙江大学教育部脑与脑机融合前沿科学中心等科研项目资助;同时感谢浙江省肿瘤代谢前沿研究重点实验室、浙江省老年医学重点实验室、以及浙江大学医学院公共技术平台的大力支持。
史鹏课题组聚焦于自主神经功能调控的机制解析,综合利用现代神经和免疫分析技术剖析影响自主神经功能的通路和分子机制。近三年分别在Immunity(3篇)、Brain Behavior & Immunity和Kidney International等期刊发表多篇论文。期待对神经、免疫和生理功能交叉方向抱有浓厚兴趣的博士和博士后加盟。
文章链接:https://doi.org/10.1016/j.immuni.2024.07.011
参考文献:
1. Lu, J., Lu, Y., Wang, X., Li, X., Linderman, G.C., Wu, C., Cheng, X., Mu, L., Zhang, H., Liu, J., et al. (2017). Prevalence, awareness, treatment, and control of hypertension in China: data from 1·7 million adults in a population-based screening study (China PEACE Million Persons Project). Lancet 390, 2549-2558. 10.1016/s0140-6736(17)32478-9.
2. Bi, Q., Wang, C., Cheng, G., Chen, N., Wei, B., Liu, X., Li, L., Lu, C., He, J., Weng, Y., et al. (2022). Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension. Immunity 55, 1466-1482.e1469. 10.1016/j.immuni.2022.06.018.
3. Shen, X.Z., Li, Y., Li, L., Shah, K.H., Bernstein, K.E., Lyden, P., and Shi, P. (2015). Microglia participate in neurogenic regulation of hypertension. Hypertension 66, 309-316. 10.1161/hypertensionaha.115.05333.
4. Zhao, T.V., Li, Y., Liu, X., Xia, S., Shi, P., Li, L., Chen, Z., Yin, C., Eriguchi, M., Chen, Y., et al. (2019). ATP release drives heightened immune responses associated with hypertension. Sci Immunol 4. 10.1126/sciimmunol.aau6426.
5. Kirst, C., Skriabine, S., Vieites-Prado, A., Topilko, T., Bertin, P., Gerschenfeld, G., Verny, F., Topilko, P., Michalski, N., Tessier-Lavigne, M., and Renier, N. (2020). Mapping the Fine-Scale Organization and Plasticity of the Brain Vasculature. Cell 180, 780-795.e725. 10.1016/j.cell.2020.01.028.


