青稞有约 | 史鹏:血压稳定,得益于小胶质细胞的这项隐藏技能
高血压,生命健康的头号隐形杀手。90%的高血压发病机制不明。浙江大学医学院附属第二医院/转化研究院史鹏以及基础医学院沈啸、谷岩教授三个研究组通过合作研究,从这个心血管疾病最为普遍的症状出发,一路顺藤摸瓜,审视了交感神经系统后,最终追踪到一群小胶质细胞的“隐藏技能”。
他们发现,静息态下的小胶质细胞通过分泌PDGFB直接作用于交感神经元上的PDGFRa,促进该神经元中编码一种钾电流通道蛋白基因的表达,从而防止其超兴奋,维持正常的交感神经张力和血压。2022年7月20日,研究论文“Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension”在Immunity杂志上线。
DOI:https://doi.org/10.1016/j.immuni.2022.06.018
本期分享 :
浙大医学院 史鹏 研究员
本期推荐 :
浙大学术委员会委员 医学院 段树民院士
Q1
您的研究有高血压发病机制相关,目前人们对于高血压的认识和临床治疗手段进展到哪一步了?还存在哪些难点?
根据临床统计,心血管疾病是全球排名第一的致死性和致残性疾病,其死亡率是排名第二位的癌症的两倍。而高血压在众多心血管疾病(如心梗、中风等)的独立风险因素中位列榜首,是导致心血管疾病以及神经退行性疾病(如阿尔兹海默症)的主要危险因素之一。
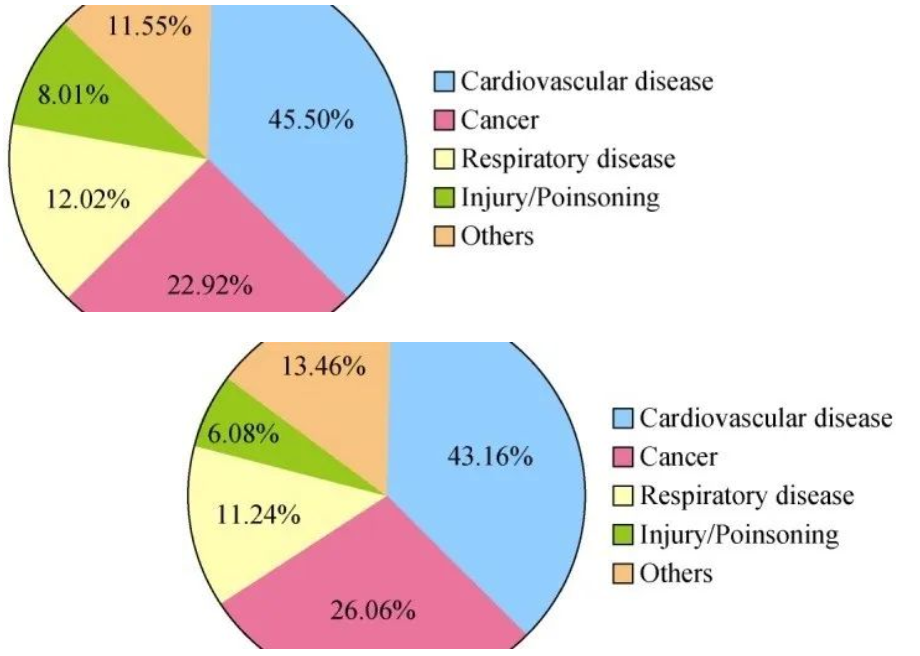
图1: 2016年中国人群死亡的主要原因;上图为农村人口统计数据,下图为城镇人口统计数据。
到目前为止,90%的高血压(收缩压/舒张压分别或者同时高于140/90mmHg),病因不明。即使我们知道一些相关因素,例如高盐、高糖饮食,生活作息,精神状态等,也并不清楚主导因素和相关发病机制。认识方面的不足也限制了在临床治疗方面的突破。据我们所知,最新获得FDA批准的降压药还停留在2007年诺华公司研发的Aliskiren(肾上腺素抑制剂),距今15年该领域再无抗高血压新药问世。目前临床针对高血压患者治疗主要的降压药主要是通过舒张外周阻力血管,或者减少体内水纳潴留达到降压效果。通常需要1~3种药物的联合使用,达到有效的抗压效果。
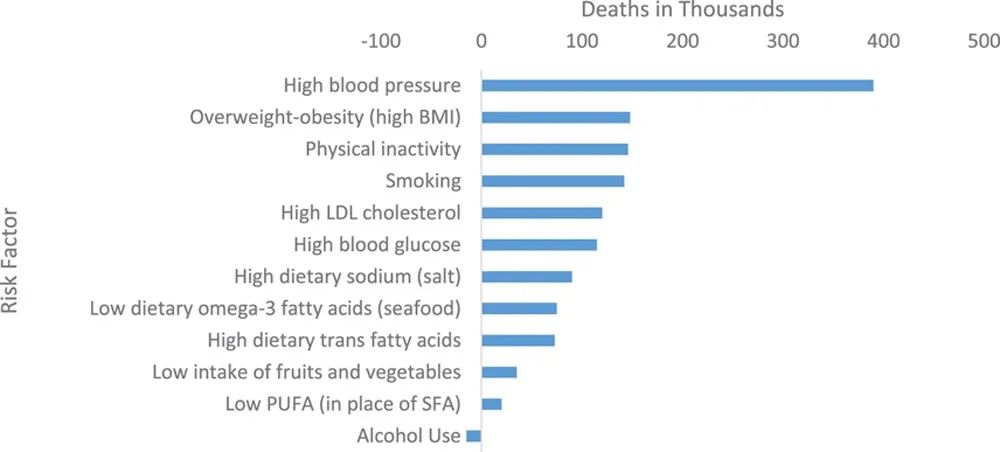
图2: 心血管疾病的独立风险因素。
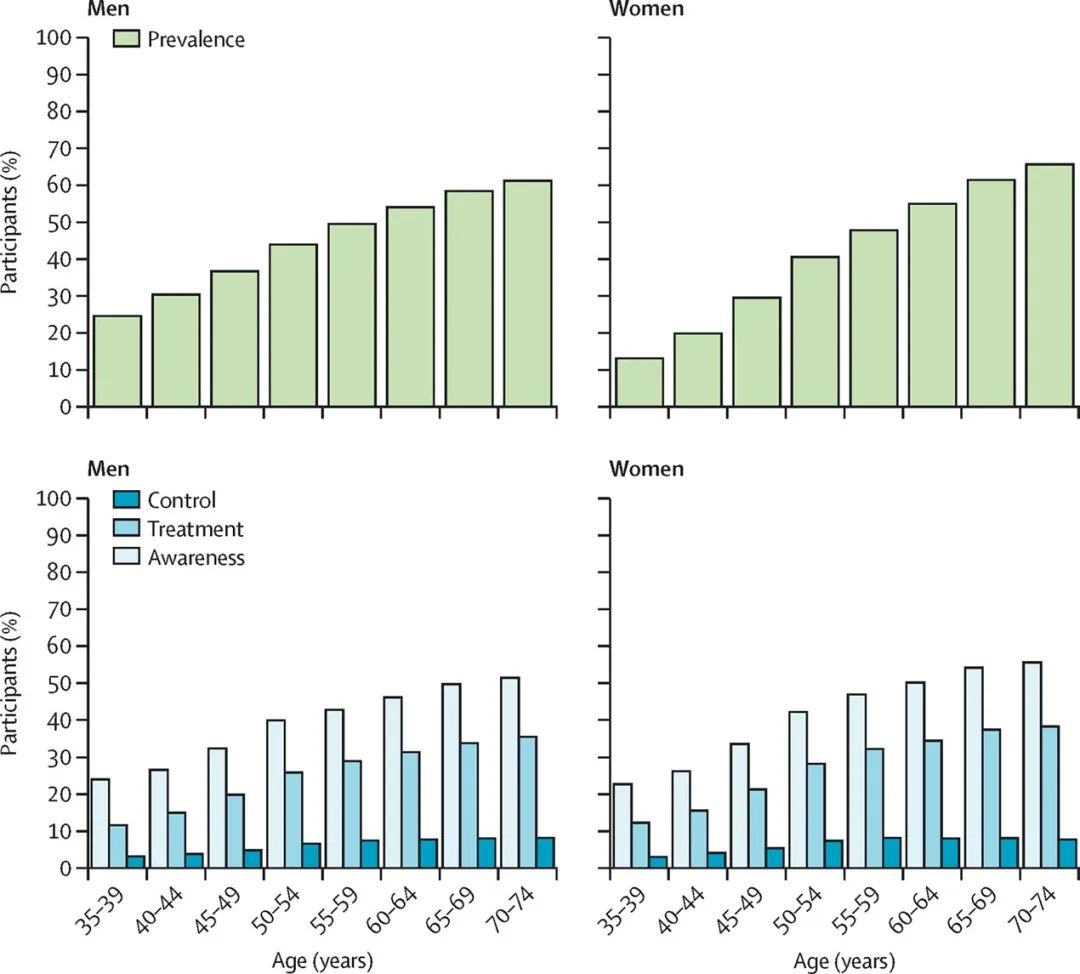
图3: 2017年对中国31个省170万成年人群的流行病调查结果显示,高血压的发病率为37.2%;接受抗压治疗率为22.9%;有效治疗率为5.7%。
即使在几种药物的联合使用下,仍然有部分患者的血压不能有效缓解,成为顽固性高血压,这部分的患者比例达到10%以上。开发新一代的降压药有赖于我们对高血压的进一步认识。
Q2
为何要从交感神经的角度去理解高血压的发病机制?
我的研究兴趣一直在关注自主神经系统和心血管疾病之间的关系。2010年《柳叶刀》报道了一项非常轰动的临床实验,采用一种相对激进的方法去解除顽固型高血压的症状。这些患者,他们在同时使用3种或者以上的降压药的情况下,高血压仍得不到缓解,而这项临床试验中,医生“熔断”了患者肾脏的交感神经(肾交感消融术,Renal nerve denervation),他们的血压得到了显著的下降。
这项研究让人们确认,交感神经高张是导致高血压进程的主要因素。受到这项研究的启发,我就想进一步从交感神经的角度去理解高血压的发病机制。事实上,研究交感神经是如何受到调控的,换言之,如何维持交感神经稳态以及病理状态下这一平衡如何被打破,是自主神经系统领域一直以来的难点。
Q3
交感神经在我们身体里是如何分布的?它是怎么调控我们的身体的?
交感神经是我们自主神经系统的一部分,与之相对应的是副交感神经。交感和副交感神经可以简单的想象成油门和刹车在汽车中的作用。副交感神经系统在休息的时候占主导地位;而交感神经的激活是让我们的身体进入紧张状态,应激就是比较极端的例子,如同一把身体的发令枪将身体的各个组织脏器协调一致。交感系统一兴奋,身体的各个系统就像听到“Ready, GO!”一样,调动身体进入紧张状态,心跳加速,血压增高、血流增快等。
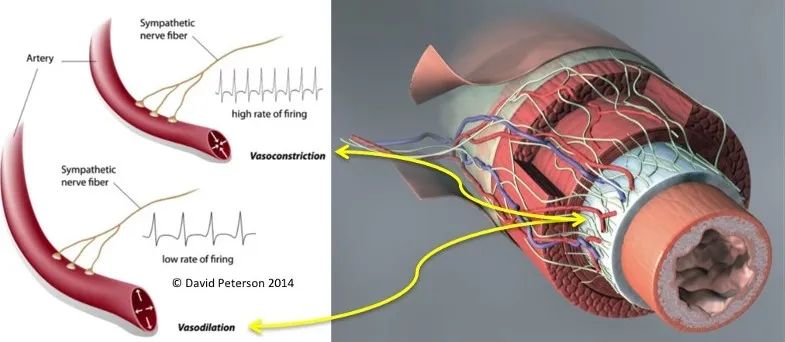
具体到心血管系统,交感神经的末梢贴着血管壁生长,它的兴奋会引起血管的收缩。我给本科生上课时常把心血管比作人体的灌溉系统,它们负责向各个器官运输营养、传递能量以及带走“废物”。心血管系统的终极目标就是达成物质的交换。维持这一功能的重要因素是正常的血压,使得血液在整个循环系统中进行有序地流动。
血压的调控可以简单套用高中物理知识点“欧姆定律”:电压取决于电流与电阻的积数。血压(电压)则取决于心输出量(电流)与外周血管阻力(电阻)。病理状态下血压的升高是由外周血管阻力的升高导致,这与运动后心输出量增多引起的血压升高截然不同。长期的高血压会导致脑血管内皮损伤以及神经-血管单元偶联障碍,导致临床常见的神经退行性病变(如阿尔兹海默症)。因此改善支配血管收缩的交感神经神经张力是解除高血压的一项有效手段,同时也是减少组织脏器损伤的重要环节。
Q4
你们的这项研究中,最核心的发现是什么?
我们通过研究了下丘脑室旁核(paraventricular nucleus [PVN])中投射到脑干头端腹侧延髓(rostroventrolateral medulla 【RVLM】)的前交感神经元(简称PVN-RVLM),发现它们受到了周围的静息态的小胶质细胞的调控。我们知道,神经元有“静息”和“激活”两种状态。我们第一次看到,小胶质细胞在静息状态下会分泌一种PDGFB的蛋白,而前交感神经元上正好有这种蛋白的受体PDGFRa。当接受到来自小胶质细胞的PDGFB后,前交感神经元上促进钾离子外流的基因就会被激活,从而防止神经过度活跃,以维持正常的交感神经张力和血压。
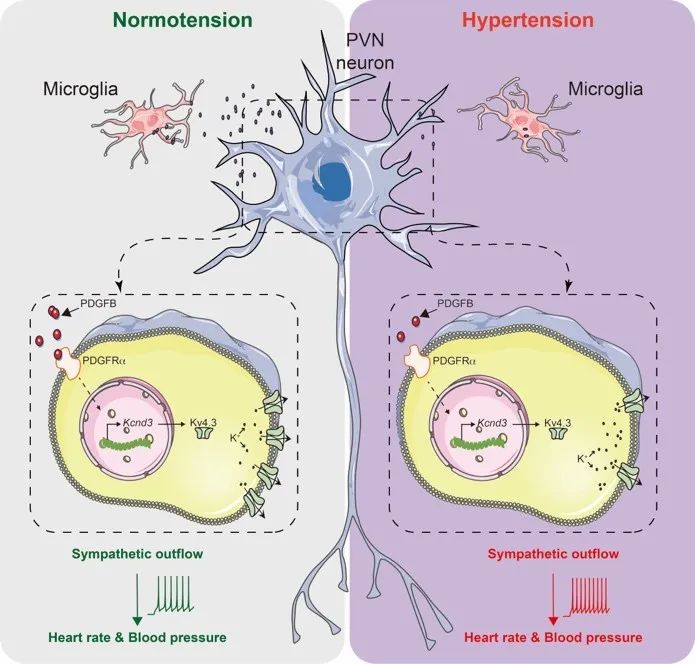
我们在实验中尝试特异性地去除了交感神经元周围的小胶质细胞,我们发现,由于没有来自小胶质细胞的PDGFB的“安抚”,神经元上促进钾离子外流的基因就无法被“唤醒”,导致它抑制神经过度活跃的功能无法执行,实验小鼠的血压也因此升高了。
Q5
小胶质细胞是一种怎样的细胞?它有哪些功能?
从100年前被神经科学家发现迄今,小胶质细胞的功能正在被逐渐认识中。小胶质细胞在所有脑细胞中大概占了10%左右。不同于脑内其它类型细胞,小胶质细胞个头很小,能量很大,且能在中枢神经系统内游走。为大家所熟知的是小胶质细胞类似于外周系统中的单核巨噬细胞,是大脑中的固有免疫细胞,充当着“清道夫”的作用。它甚至可以 “修剪”神经元上冗余的棘突,强化神经元间的有效交互;有研究发现小胶质细胞还可以促进神经元的新生。
近年来随着对神经退行性疾病研究的深入,小胶质细胞作为推进神经元损伤的主要因素被逐渐揭示出来。这可能与小胶质细胞是最早响应神经炎症或损伤,进而改变活性状态以适应新的环境有关。随着新技术,比如单细胞测序、蛋白质组学、表冠遗传学等,在脑神经领域的应用,人们从细胞分子层面逐渐揭示出小胶质细胞对疾病进程的影响,并以此为突破口提出了治疗神经源性疾病全新的思路和靶点。
Q6
这是否是人们第一次认识到小胶质细胞在静息状态下对神经元的作用?
以前对小胶质细胞的认识,主要集中在它的激活状态。对于它在静息状态的情况并不了解。确切的说这是第一次发现静息态的小胶质细胞能够直接影响神经元的电兴奋性,这一作用直接关系到交感神经的稳态的调节。我们揭示了它通过防止神经元超兴奋的分子机制,达到对交感系统以及心血管功能的“维稳”作用。并且我们有初步的证据提示这一调节机制在整个中枢神经系统中存在一定的普适性。
Q7
这项研究在临床诊疗方面会有哪些影响?
我们这项研究中涉及到的交感神经上的PDGFR受体是酪氨酸激酶(家族成员,其抑制剂是临床中广泛使用的抗肿瘤药物之一,通过抑制血管新生达到抗肿瘤的效果。临床上发现使用这类药物会导致肿瘤患者血压升高,其中一种药物pazopanib使用后高血压的发生率高达40%。
我们在研究中,给正常血压小鼠使用相当人体临床剂量的pazopanib,小鼠就会出现PVN-RVLM神经元钾电流降低、交感高张、高血压的表型,与临床报道极为相似。人为的让该类神经元强制表达钾通道蛋白,就能完全消除这一药物造成的高血压。我们认为我们的研究发现能够从部分解释这类抗肿瘤药物导致高血压副作用的原因。神经元异常性兴奋导致的疾病有很多,譬如癫痫。我们的研究发现去除小胶质细胞中的PDGFB或者阻断PDGF受体加速了小鼠癫痫的进程。提示可以通过靶向这一通路改变神经元的异常放电。
Q8
下一步你们还将进行哪些方面的探索?
接下来的重点是进一步解析心血管疾病下交感高张的原因,研究小胶质细胞是否介导了血液动力紊乱与中枢神经系统异常间的关键桥梁。我们人为靶向脑内的小胶质细胞,有望成为打破疾病恶性循环的关键节点。
参考文献:
1. China cardiovascular diseases report 2018: an updated summary. Ma LY, Chen WW, Gao RL, Liu LS, Zhu ML, Wang YJ, Wu ZS, Li HJ, Gu DF, Yang YJ, Zheng Z, Hu SS.J Geriatr Cardiol. 2020 Jan;17(1):1-8. doi: 10.11909/j.issn.1671-5411.2020.01.001.PMID: 32133031
2.Call to Action: Urgent Challenges in Cardiovascular Disease: A Presidential Advisory From the American Heart Association. McClellan M, Brown N, Califf RM, Warner JJ. Circulation. 2019 Feb 26;139(9):e44-e54. doi:10.1161/CIR.0000000000000652. PMID: 30674212
3.Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomised controlled trial. Symplicity HTN-2 Investigators, Esler MD, Krum H, Sobotka PA, Schlaich MP, Schmieder RE, Böhm M.Lancet. 2010 Dec 4;376(9756):1903-9. doi: 10.1016/S0140-6736(10)62039-9. Epub 2010 Nov 17.PMID: 21093036


