Cell Death and Differentiation丨赵永超团队在泛素连接酶β-TrCP1和β-TrCP2调控的分子机制及其生物学功能的差异研究中取得重要进展
β-TrCP是SCF E3泛素连接酶复合物的底物识别受体,负责识别特异的蛋白底物并启动其泛素化降解。哺乳动物中存在两个生物化学结构类似的β-TrCP基因:β-TrCP1和β-TrCP2,它们在进化上高度保守,提示β-TrCP1和β-TrCP2可能发挥着不同的生物学功能。β-TrCP1/2通过介导一系列具有重要生物学功能的底物蛋白质,如IκB,PDCD4和β-catenin等的泛素化降解,参与调控多种生理和病理学过程。因此,β-TrCP1/2蛋白水平需要受到严格的调控。然而,目前并不清楚调控其蛋白水平和活性的上游信号通路和分子机制。此外,也不清楚为什么哺乳动物在进化过程中需要保留两个结构和生化功能类似的不同基因。
近日,浙江大学医学院附属第一医院、转化医学研究院赵永超课题组在《Cell Death and Differentiation》杂志发表题为“The Cross Talk of Two Family Members of β-TrCP in the Regulation of Cell Autophagy and Growth”的研究论文,该研究揭示了β-TrCP1和β-TrCP2这两个同源蛋白的相互调控机制,并且发现β-TrCP2作为主要的同源蛋白在细胞自噬和生长中发挥重要调控作用。

在这项研究中,研究者运用多种生物化学、细胞生物学手段,在生理条件下证明了,β-TrCP1和β-TrCP2是SCF E3泛素连接酶的底物;β-TrCP2能够识别β-TrCP1上特异的β-TrCP降解基序(degron motif)并介导β-TrCP1的泛素化降解过程;同时,β-TrCP2也是SCFβ-TrCP1的降解底物且依赖于β-TrCP2上的β-TrCP降解基序。进一步的研究表明,糖剥夺和血清饥饿启动β-TrCP1经UPS泛素化降解。具体机制研究证明,糖剥夺情况下,AMPK活化并磷酸化β-TrCP1,促进其经过SCFβ-TrCP2泛素化修饰而降解。
此外,在β-TrCP1和β-TrCP2生物学功能差异研究方面,利用siRNA分别敲减β-TrCP1和β-TrCP2,模拟其降解,研究者发现β-TrCP1和β-TrCP2的功能并非冗余。敲减β-TrCP2,而不是β-TrCP1,能够诱导细胞发生自噬,并抑制细胞生长。分子机制研究表明,只有β-TrCP2能选择性降解mTORC1的抑制蛋白DEPTOR 和REDD1,而mTORC1是调控细胞自噬和生长的核心因子。因此,β-TrCP2作为主要的β-TrCP同源蛋白通过调控细胞自噬和生长发挥原癌蛋白的特性(图1)。
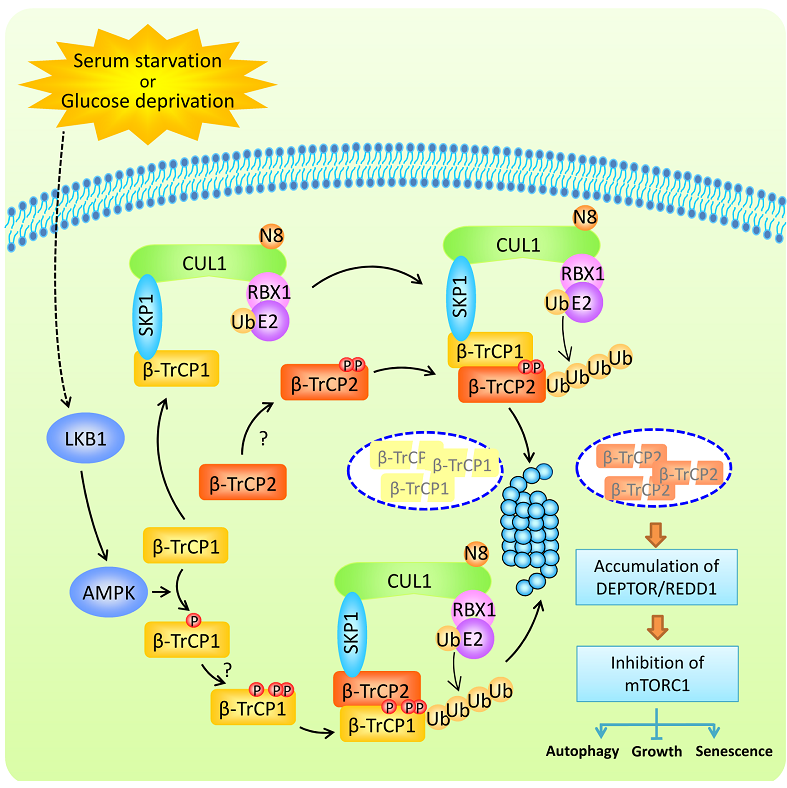
图1. β-TrCP1/2降解及生物学功能差异模式图
浙江大学附属第一医院崔丹蕊博士为该文第一作者,赵永超研究员为通讯作者。该研究受到国家重点研发计划“蛋白质机器与生命过程调控”专项、国家自然科学基金和浙江省自然科学基金等项目的资助。
此外,赵永超团队围绕SCFβ-TrCP泛素连接酶做出了多项重要发现。先后发现SCFβ-TrCP泛素连接酶靶向降解mTOR的直接抑制物DEPTOR,从而调节mTOR信号通路的活性和化疗药物耐药[1];在葡萄糖缺失的条件下,靶向降解细胞周期检测点激酶CHK1,促进肿瘤细胞的存活和基因组不稳定性,从而导致肿瘤的异质性[2];在化疗药物TOP2毒物治疗的情况下,诱导TOP2β降解,促进肿瘤细胞的存活,并诱导TOP2毒物的心脏毒性和二次肿瘤(如淋巴瘤)发生等副作用[3];以及利用基因修饰小鼠模型证明SCFβ-TrCP泛素连接酶的重要底物DEPTOR通过抑制mTOCR1和mTOCR2在前列腺癌发生中充当抑癌蛋白作用[4]。
原文链接:https://www.nature.com/articles/s41418-019-0402-x
参考文献
1. Zhao Y, Xiong X, Sun Y. DEPTOR, an mTOR inhibitor, is a physiological substrate of SCF(betaTrCP) E3 ubiquitin ligase and regulates survival and autophagy. Mol Cell. 2011;44:304-316.
2. Ma Y, Cui D, Xiong X, Inuzuka H, Wei W, Sun Y, North BJ, Zhao Y. SCFbeta-TrCP ubiquitinates CHK1 in an AMPK-dependent manner in response to glucose deprivation. Mol Oncol. 2019;13:307-321.
3. Shu J, Cui D, Ma Y, Xiong X, Sun Y, Zhao Y. SCF(beta-TrCP)-mediated degradation of TOP2beta promotes cancer cell survival in response to chemotherapeutic drugs targeting topoisomerase II. Oncogenesis. 2020;9:8.
4. Chen X, Xiong X, Cui D, Yang F, Wei D, Li H, Shu J, Bi Y, Dai X, Gong L, Sun Y, Zhao Y. DEPTOR is an in vivo tumor suppressor that inhibits prostate tumorigenesis via the inactivation of mTORC1/2 signals. Oncogene. 2020;39:1557-1571.


