Blood丨Blood亮点评述:闵军霞/王福俤团队在肝纤维化及铁死亡领域重大成果
8月7日,国际血液学著名学术期刊《Blood》(影响因子17.54)正式发表浙江大学医学院转化医学研究院闵军霞/浙江大学医学院王福俤团队新成果;并就铁死亡及肝纤维化防治的前景做积极展望[1]。《Blood》同期配发评述“Iron Turns To Wild When The Transferrin Is Away”[2]。该评述作者为美国布朗大学医学院Wentian Yang教授。评述系统评价和高度肯定与赞扬。
《Blood》杂志网页主页截屏
Blood评述全文免费下载链接:
https://ashpublications.org/blood/article/136/6/649/461628/Iron-turns-to-wild-when-the-transferrin-is-away
《Blood》亮点评述截屏

《Blood》评述“Iron Turns To Wild When The Transferrin Is Away”

《Blood》评述“Iron Turns To Wild When The Transferrin Is Away”
《Blood》作为亮点论文在线发表闵军霞/王福俤/郑树森院士团队题为“Hepatic Transferrin Plays a Role in Systemic Iron Homeostasis and Liver Ferroptosis”的研究成果[1]。(营养发现,文稿链接)。成果首次揭示并阐明转铁蛋白通过调控铁死亡抑制肝脏纤维化发生的生理效应及分子机制;并首次利用动物模型通过大量坚实科学数据展示转运蛋白Slc39a14通过促进肝脏吸收非转铁蛋白结合铁(Non-Transferrin Bound Iron, NTBI)而诱发肝实质细胞发生铁死亡,进而导致肝脏纤维化的发生,有望成为肝脏纤维化防治的新靶点。
闵军霞/王福俤教授领衔的科研团队曾多次率先报道铁死亡在心脏及肝脏损伤引起的重大疾病中的作用及分子调控机制;团队成功利用多种铁代谢及铁死亡基因敲除和转基因小鼠模型深入探索并阐明铁死亡引起心脏和肝脏损伤的新机制,研究成果先后在《Hepatology》(封面论文)、《PNAS》(年度高被引论文)及《Circulation Research》等国际著名期刊报道[3-5],为心脏及肝脏疾病的防治提供了新思路和新策略。

闵军霞/王福俤团队《Blood》论文首页

闵军霞/王福俤团队近年“铁死亡”相关研究论文
评述开篇描写到“In this issue of Blood, Yu et al. report a pivotal role of the hepatic transferrin in the regulation of systematic iron metabolism, erythropoiesis, and in the protection of liver from iron overload-evoked ferroptosis, fibrosis and cirrhosis. Based on their novel findings, the authors propose a potential therapeutic strategy to mitigate a spectrum of iron overload disorders by targeting iron-evoked ferroptosis and/or the divalent metal transporter Slc39a14。”评述对应大大意为:“在这一创新型研究中,作者们首次报道了肝脏Transferrin在机体铁稳态及造血调控、保护铁过载诱发的铁死亡及肝脏纤维化/肝硬化中的关键作用。基于这一重要发现,作者们进一步提出通过靶向铁死亡或/及转运蛋白Slc39a14来缓解肝损伤的潜在治疗措施。”
评述正文首先简要介绍了铁稳态代谢及转铁蛋白调控的研究进展。Transferrin早在1947年被发现是一个重要的血液中的铁结合蛋白,人类对Transferrin蛋白的理解多来自先天性低转铁蛋白血症遗传病及Hpx先天突变小鼠模型的研究。然而一直以来,人们始终不知道组织特异性来源的Transferrin到底在铁代谢和生理病理中起什么样的作用。评述向读者深入浅出地讲解了王福俤教授团队《Blood》研究设计与结果。研究团队利用LoxP/Cre技术在国际上成功构建第一个Transferrin条件性敲除小鼠,这一崭新的模型为铁代谢领域深入探索不同组织来源的Transferrin的作用提供新的手段。该研究在小鼠体内(In Vivo)首次揭示肝脏来源的Transferrin在维持机体造血和铁代谢的动态平衡发挥重要作用。此外,作者团队通过临床相关分析,发现转铁蛋白缺乏在肝纤维化的发生发展中可能扮演重要角色。通过进一步探究,利用膳食高铁模型和四氯化碳模型,发现Transferrin 肝脏敲除(Trf-LKO)小鼠,更易发生铁死亡诱导的肝损伤。阐明了肝脏转铁蛋白通过铁死亡促发肝脏纤维化的分子机制。评述提出,这些令人激动的重要发现(exciting and important findings)系统解释了肝脏疾病发生的病理机制,为特殊人类疾病中铁代谢异常及铁死亡发生的病理学研究提供了理论基础,并为开发新型药物靶向铁代谢异常相关疾病提供研究基础(provide the rationale for attributing iron metabolic deregulation and ferroptosis to the etiology of certain human diseases, and the development of novel therapeutics correcting iron metabolic disorders)。
评述继续深入分析了研究成果:在进一步的机制研究中,作者们首次展示了转运蛋白Slc39a14在肝脏中转运非转铁蛋白结合铁non-transferrin-binding iron (NTBI)的重要作用。研究团队充分展示了Trf和Slc39a14双敲小鼠惊奇地(Fascinatingly)逆转Trf缺失诱发的肝脏损伤表型。Wentian Yang教授指出这些结果提供了强有力的证据(provide strong evidence)证实Slc39a14是关键的肝脏NTBI通道蛋白,通过增加细胞内的NTBI的转运而发挥促进铁死亡发生的关键分子调控机制;并提出Slc39a14是低转铁蛋白相关的肝脏疾病防控的重要新靶点。
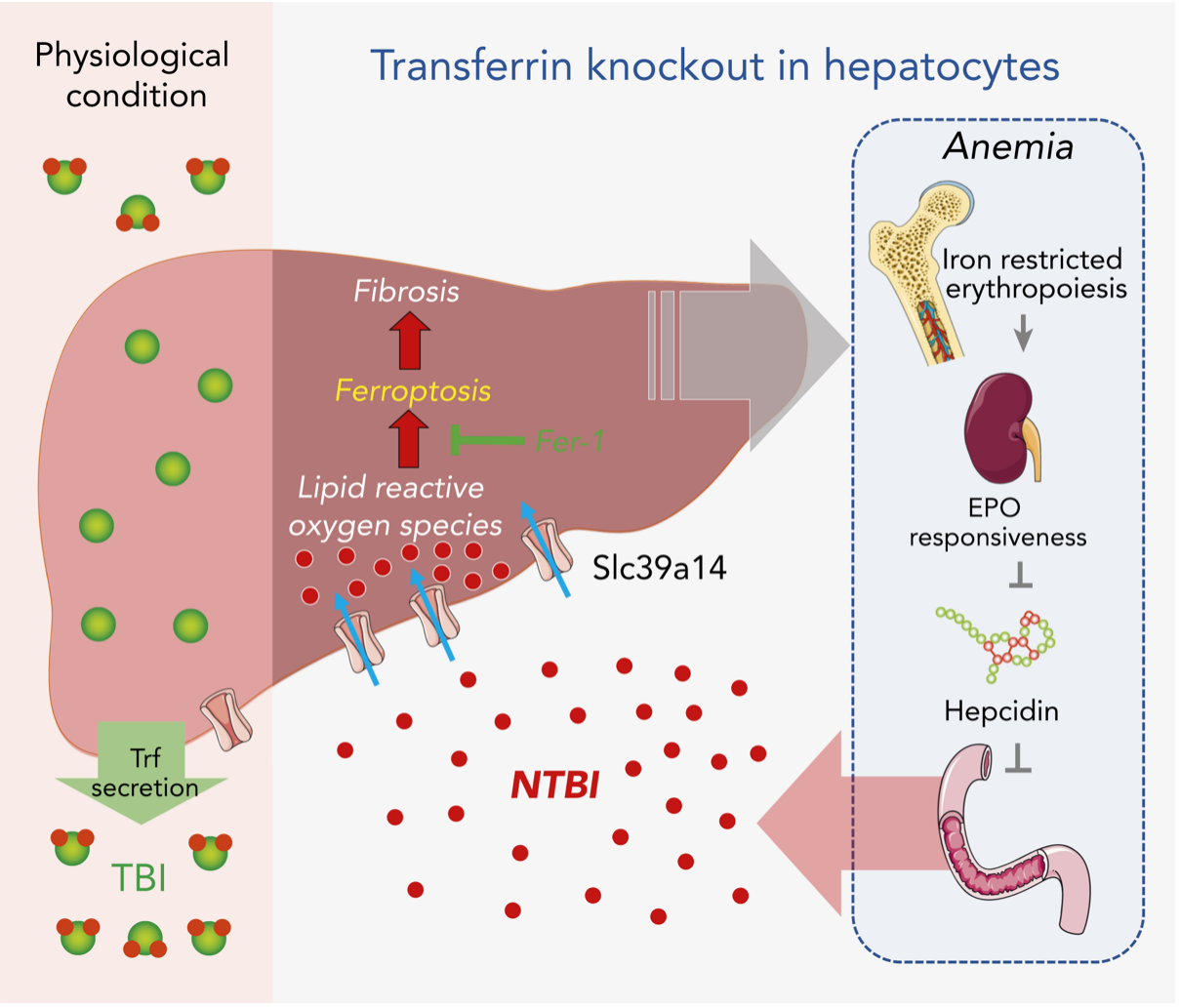
Iron Turns To Wild When The Transferrin Is Away”
示意图(Blood 2020)
在谈及这项研究的重要意义时,评论指出,这一项创新型的重要研究具有巨大的转化潜力(The novel findings of this study are important and of great translational potential)。该研究为开发新型药物靶向铁过载及铁死亡引发的肝纤维化提供了坚实的基础(builds a strong foundation)。此外,该研究全面解读(a thorough understanding)了铁代谢稳态调控的重要作用,并为建立膳食指南来防治铁紊乱相关疾病提供了理论依据(instrumental)。
《Blood》评论论文链接:
https://ashpublications.org/blood/article/136/6/649/461628/Iron-turns-to-wild-when-the-transferrin-is-away
《Blood》论文链接:
https://ashpublications.org/blood/article/doi/10.1182/blood.2019002907/454783/Hepatic-Transferrin-Plays-a-Role-in-Systemic-Iron
参考文献:
[1] Yingying Yu#, Li Jiang#, Hao Wang, Zhe Shen, Qi Cheng, Pan Zhang, Jiaming Wang, Qian Wu, Xuexian Fang, Lingyan Duan, Shufen Wang, Kai Wang , Peng An, Tuo Shao, Raymond T Chung, Shusen Zheng*, Junxia Min*, Fudi Wang*. Hepatic Transferrin Plays a Role in Systemic Iron Homeostasis and Liver Ferroptosis. Blood (2020) 136 (6): 726–739. (亮点论文)
[2] Wentian Yang. Iron Turns To Wild When The Transferrin Is Away. Blood (2020) 136 (6): 649–650.
[3] Hao Wang, Peng An, Enjun Xie, Qian Wu, Xuexian Fang, Hong Gao, Zhuzhen Zhang, Yuzhu Li, Xudong Wang, Jiaying Zhang, Guoli Li, Lei Yang, Wei Liu, Junxia Min* and Fudi Wang*. Characterization of Ferroptosis in Murine Models of Hemochromatosis. Hepatology 2017, doi:10.1002/hep.29117. PMID: 28195347 (Cover Story)
[4] Xuexian Fang, Hao Wang, Dan Han, Enjun Xie, Xiang Yang, Jiayu Wei, Shanshan Gu, Feng Gao, Nali Zhu, Xiangju Yin, Qi Cheng, Pan Zhang, Wei Dai, Jinghai Chen, Fuquan Yang, Huang-Tian Yang, Andreas Linkermann*, Wei Gu*, Junxia Min* and Fudi Wang*. Ferroptosis as a novel target for protection against cardiomyopathy. Proceedings of the National Academy of Sciences USA, 2019, Feb 12;116(7):2672-2680. doi: 10.1073/pnas.1821022116. PMID: 30692261 (高被引论文)
[5] Xuexian Fang, Zhaoxian Cai, Hao Wang, Dan Han, Qi Cheng, Pan Zhang, Feng Gao, Yingying Yu, Zijun Song, Qian Wu, Peng An, Sicong Huang, Jianwei Pan, Hou-Zao Chen, Jinghai Chen, Andreas Linkermann, Junxia Min, *and Fudi Wang*. Loss of Cardiac Ferritin H Facilitates Cardiomyopathy via Slc7a11-Mediated Ferroptosis. Circulation Research. 2020 Apr 30. doi: 10.1161/CIRCRESAHA.120.316509. Online ahead of print. PMID: 32349646


