Cell Reports | 孙毅组揭示两种RING泛素E3连接酶相互间负向调控的作用机制及意义
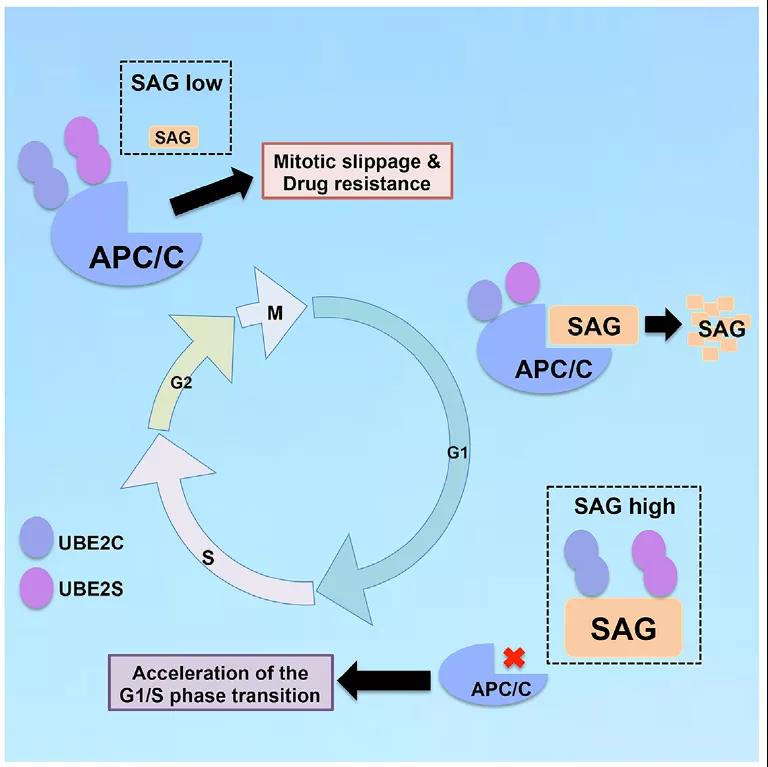
RING结构域泛素化连接酶E3是泛素化连接酶中的最大家族,主要成员包括CRL(Cullin-RING连接酶)和APC/C(Anaphase-Promoting Complex)两大类。CRL复合体主要由支架蛋白Cullin,底物识别蛋白F-box,适配蛋白及RING结构蛋白组成。目前发现仅两种RING结构蛋白RBX1/ROC1和RBX2/ROC2/SAG 参与构成CRL。RBX2/ROC2/SAG蛋白是首先由浙江大学孙毅教授在1999年完成克隆并发现了其具有保护细胞发生凋亡的作用【1】。后来发现SAG蛋白还可以作为RING结构蛋白参与构成CRL促进底物蛋白泛素化降解。另外,在2016年孙毅课题组还发现这两类RING结构蛋白构成的CRL促进底物发生泛素化修饰的作用方式大有不同。RBX1/E3主要通过结合CDC34和UBCH2C这两个E2促进底物发生K48连接的泛素化修饰,而SAG/E3主要通过结合UBE2C和UBE2S两个E2促进底物发生K11连接的泛素化修饰【2】。而众所周知的是APC/C也是通过与UBE2C和UBE2S结合作用促进底物的K11连接的泛素化修饰。而且UBE2C和UBE2S是周期性表达的蛋白【3】,说明其蛋白含量在细胞内表达并不饱和。那么SAG/E3和APC/C这两个E3之间会不会存在因为竞争性结合E2而发生一系列的相互作用关系呢?
2020年9月8日,孙毅课题组在Cell Reports上发表了题为 The negative cross-talk between SAG/RBX2/ROC2 and APC/C E3 ligases in regulation of cell cycle progression and drug resistance 的研究论文对上述问题进行了相关解答。

在这项研究中,研究人员首先发现敲低SAG基因后肿瘤细胞内APC/C与UBE2C和UBE2S的结合增加,从而激活APC/C泛素化活性,导致APC/C的相关底物降解增加。从生物学效应上来看,敲低SAG后导致APC/C泛素化活性增强主要影响肿瘤细胞分裂M期的进程增快;促进肿瘤细胞在抗微管药物有丝分裂阻滞作用下发生逃逸(Mitotic Slippage),导致肿瘤细胞对抗微管药物更加抵抗,产生耐药性。另一方面,在细胞G1期,APC/CCDH1可以通过识别结合SAG蛋白的D-box序列,促进SAG蛋白发生降解。而SAG在G1期维持在低水平表达对细胞周期的G1-S期转变至关重要,因为D-box突变的SAG蛋白或过量表达的SAG蛋白在G1期可以通过竞争性结合UBE2C/2S抑制APCCDH1的活性,从而促进细胞G1-S期转变,导致肿瘤细胞增殖增快。这也可以部分解释SAG蛋白的促细胞生长活性。
总的说来,SAG和APC/C 二个E3泛素连接酶存在着相互间的负向调控,确保细胞周期的正常运行,而破坏该平衡会导致细胞增生和耐药。
据悉,该研究主要由孙毅教授课题组的肿瘤学博士生章时珍完成,为该文的第一作者,孙毅教授为通讯作者。
原文链接:
https://doi.org/10.1016/j.celrep.2020.108102
参考文献
1. Duan, H., Y. Wang, M. Aviram, M. Swaroop, J.A. Loo, J. Bian, Y. Tian, T. Mueller, C.L. Bisgaier, and Y. Sun, SAG, a novel zinc RING finger protein that protects cells from apoptosis induced by redox agents. Mol Cell Biol, 1999. 19(4): p. 3145-55.
2. Kuang, P., M. Tan, W. Zhou, Q. Zhang, and Y. Sun, SAG/RBX2 E3 ligase complexes with UBCH10 and UBE2S E2s to ubiquitylate β-TrCP1 via K11-linkage for degradation. Sci Rep, 2016. 6: p. 37441.
3. Rape, M. and M.W. Kirschner, Autonomous regulation of the anaphase-promoting complex couples mitosis to S-phase entry. Nature, 2004. 432(7017): p. 588-95.


