Nat Cell Biol | 吕志民/许大千团队发现代谢酶FBP1可作为蛋白磷酸酶调控基因转录

新陈代谢是生命的基本特征,作为生命代谢过程的主要参与者,代谢酶除了发挥其经典功能为细胞提供必要的物质和能量外,还能通过一些非经典/非代谢(Moonlighting)的功能调控多种复杂的细胞活动和肿瘤的发生发展。例如,近年来陆续多个代谢酶被发现具有蛋白激酶活性,在基因表达、细胞周期、DNA损伤修复、细胞增殖、存活、凋亡和肿瘤微环境调控中发挥重要作用。然而,目前在肿瘤的发生发展过程中,代谢酶是否能够行使蛋白磷酸酶的功能仍不得而知。
2022年10月20日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心吕志民/许大千团队在 Nature Cell Biology 杂志上在线发表了题为 Fructose-1,6-bisphosphatase 1 functions as a protein phosphatase to dephosphorylate histone H3 and suppresses PPARα-regulated gene transcription and tumour growth 的研究论文,首次揭示了代谢酶FBP1能够作为蛋白磷酸酶调控基因转录。

瓦博格效应是肿瘤细胞的重要代谢特征,它是指即使在氧气充足的情况下,肿瘤细胞仍主要通过糖酵解获得能量。作为糖酵解的逆反应,糖异生是指生物体将多种非糖物质转变成葡萄糖或糖原的过程。果糖-1, 6-二磷酸酶(fructose-1,6-bisphosphatase,FBP)是糖异生的限速酶,具有FBP1 和FBP2 两个亚型,催化果糖-1,6-二磷酸水解为果糖-6-磷酸。FBP1 在生理条件下以同源四聚体形式存在,属于构象调节酶,它的酶活性受腺苷-磷酸(adenosine monophosphate,AMP)的别构抑制。众所周知,肿瘤在体内生长环境中时常处于营养缺失及能量应激状态,它会导致细胞内ATP浓度的降低,AMP浓度的增高,进而导致FBP1 原本的代谢激酶活性被累积的AMP 所抑制。
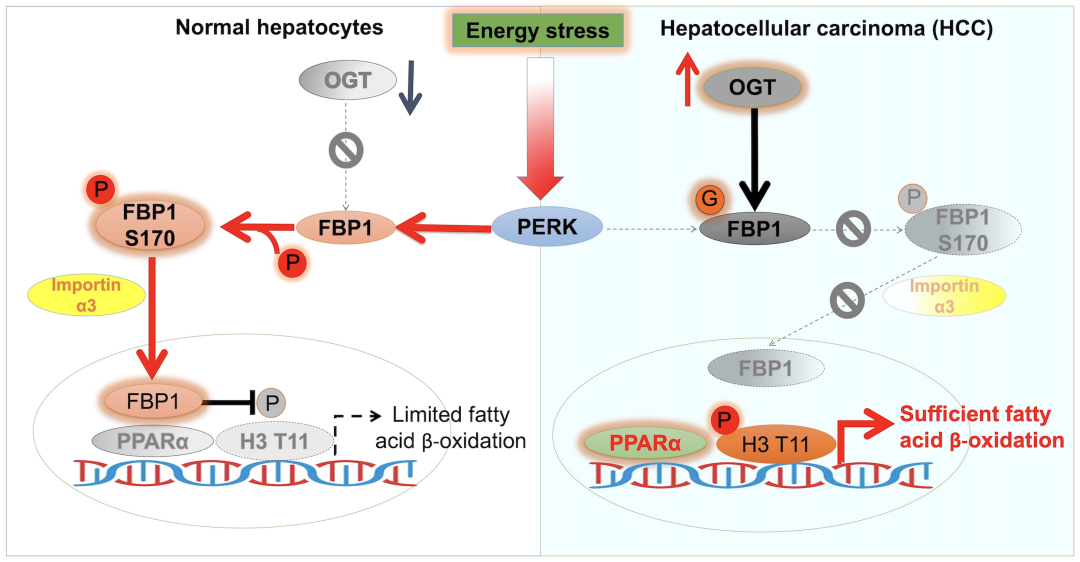
吕志民团队发现,在能量应激条件下,FBP1被赋予了前所未知的生物学功能。在正常肝细胞中,能量应激导致了PERK1磷酸化FBP1 S170,促使FBP1四聚体的解离,糖异生代谢酶功能的抑制,并诱导其单体进入细胞核。在细胞核内,FBP1与转录因子PPARα结合。重要的是, FBP1作为蛋白磷酸酶,去除了PPARα启动子区域组蛋白H3的T11磷酸化,进而抑制了PPARα介导的脂肪酸氧化相关基因的转录和线粒体内的脂肪酸氧化,导致了能量缺失和细胞凋亡。
但是肝癌细胞演化出新的调节机制抑制了上述FBP1的功能。肝癌细胞中,糖基转移酶OGT高表达,促进FBP1 S124 O-糖基化,进而抑制了PERK1介导的FBP1 S170磷酸化及其细胞核易位, 因此,FBP1在细胞核内蛋白磷酸酶功能缺失,促进了蛋白H3的T11磷酸化,以及PPARα介导的线粒体脂肪酸氧化,为肿瘤细胞提供了充足的能量以保障其在能量应激条件下的生长和存活。
综上所述,FBP1可以作为蛋白磷酸酶发挥其抑癌功能,而肿瘤细胞中的FBP1的O-糖基化或FBP1的缺失/低表达(如肾透明细胞癌)去除了其抑癌功能,导致了肿瘤的发生发展。
本研究首次揭示了代谢酶能够行使蛋白磷酸酶的功能,系统阐明了正常肝细胞和肿瘤细胞脂质分解代谢的差异调控机制;同时深入解析了能量应激条件下,肿瘤糖代谢重编程和脂质分解代谢的交互调控和机制关联,为靶向调节FBP1的蛋白磷酸酶功能的抗肿瘤药物开发奠定了理论基础。
值得一提的是,该研究是吕志民团队继发现代谢酶(PKM2、PGK1、KHK-A、PCK1, CHKα、HK2)的蛋白激酶活性在肿瘤发生发展中发挥重要作用的系列工作之后,发现的第一个具有蛋白磷酸酶活性的代谢酶。代谢酶不再被认为只有一个功能,只能催化一步酶促反应,而是在癌基因和特有的肿瘤微环境的共同作用下,可以发挥多种不同的非经典功能,协同调控肿瘤的发生发展。上述研究对肿瘤代谢的全方位系统认知具有开创性的理论意义。


