Cell Research丨闵军霞/王福俤/周强团队联袂解析铁死亡关键蛋白复合物xCT-4F2hc结构及Erastin作用机制
铁死亡(Ferroptosis)理论面世,一晃十周年啦
近日,浙江大学转化医学研究院闵军霞教授、浙江大学医学院王福俤教授和西湖大学周强研究员团队合作解析了细胞铁死亡关键转运蛋白xCT-4F2hc复合物结合铁死亡激活剂erastin的冷冻电镜结构,分辨率为3.4Å,功能验证了关键的药效结合位点,揭示了铁死亡激活剂erastin的作用机制。研究成果于2022年3月29日在线发表在国际学术期刊Cell Research上,题目为:“The structure of erastin-bound xCT-4F2hc complex reveals molecular mechanisms underlying erastin induced ferroptosis”【1】。该研究是铁死亡研究领域和相关领域的重要进展与突破,为进一步的药物设计和开发奠定了基础。这是铁死亡科学领域针对铁死亡机制解析的第一个蛋白质复合物结构。
全文免费下载链接

图1. Cell research论文首页截图
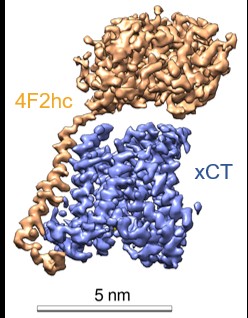
图2 xCT-4F2hc复合物冷冻电镜图
铁死亡是铁离子依赖、非凋亡的程序性死亡方式,业已成为生物医学全球十大热点。众所周知,铁死亡的一个重要特征是脂质过氧化发生并在膜上不断积累,而谷胱甘肽(GSH)是细胞内行使抗氧化过程中的关键物质。其上游的Xc-系统是对向氨基酸转运复合物,由轻链xCT蛋白(又称为SLC7A11)和重链4F2hc蛋白(又称为SLC3A2)两个亚基组成,向细胞内转入胱氨酸的同时以1:1的比例从细胞内转出谷氨酸。进入细胞的胱氨酸被还原成半胱氨酸,其是合成抗氧化功能的谷胱甘肽(GSH)的重要原料【2-5】。
国际上众多研究团队观察到并确认了化学小分子Erastin可显著抑制xCT的功能,从而诱发细胞发生铁死亡;Erastin更是科学实验中最为广泛使用的铁死亡激活剂。但Erastin引发铁死亡的分子机制至今仍是个谜团。
研究人员经过反复技术改进,利用冷冻电镜解析了分辨率为3.4Å的结合erastin的xCT-4F2hc的复合物结构(图a-c)。其中xCT和4F2hc主要靠极性和疏水作用在细胞外和跨膜区相互作用。同时,xCT的第158位胱氨酸和4F2hc的第211位胱氨酸可以形成二硫键(图d-f)。另外,有两个脂质分子结合在xCT靠近胞内的跨膜区域。其次,4F2hc跨膜螺旋之前的残基形成一个短螺旋(H1')将 xCT 固定在细胞内一侧(图g)。
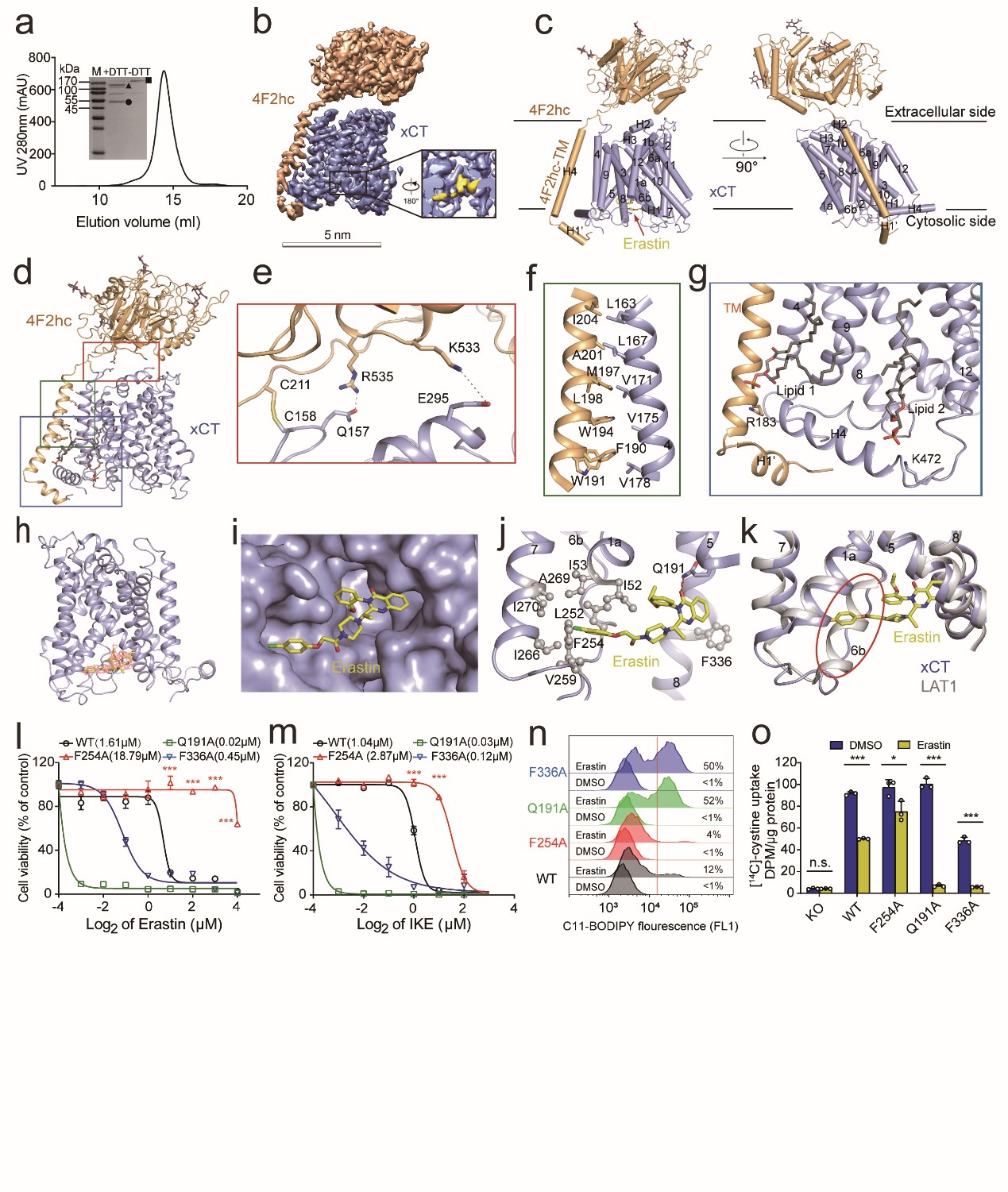
图3 xCT-4F2hc复合物详细结构
研究人员接着将xCT-4F2hc电镜结构与同家族蛋白复合物LAT1-4F2hc进行比较。从整体上看,两个复合物结构非常相似(图4)。周强研究员团队在2019年成功解析了LAT1-4F2hc复合物结构,成果发表在Nature杂志上【6】。LAT1(又称为SLC7A5)的主要功能是以一种不依赖于钠和pH的方式向胞内转运侧链较大的中性氨基酸,此外还参与荷尔蒙类药物、甲状腺激素等跨膜运送。LAT1-4F2hc复合物在多种癌细胞中过表达,是重要的抗癌药物研究靶点。
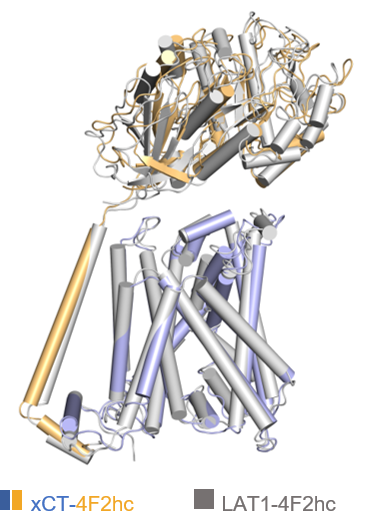
图4 xCT-4F2hc复合物和LAT1-4F2hc复合物结构对比
研究人员进一步在xCT胞内域观察到分辨率良好的非蛋白质密度,其密度形状与erastin吻合(图5.a)。Erastin被夹在xCT的跨膜螺旋(TM)结构域之间(图5.b-c)。具体来讲,erastin一端的氯苯氧基伸出到由 TM1a、TM6b 和 TM7 排列组成的疏水口袋中,且它的苯环与TM6b中的Phe254相互作用。Erastin的另一端,喹唑啉醇基团位于由TM5 和TM8 包围的疏水口袋中,且与Gln191和Phe336相互作用(图5.c)。在LAT1蛋白中形成螺旋二级结构的TM6b,在xCT中变成了一个环(图5.d)。
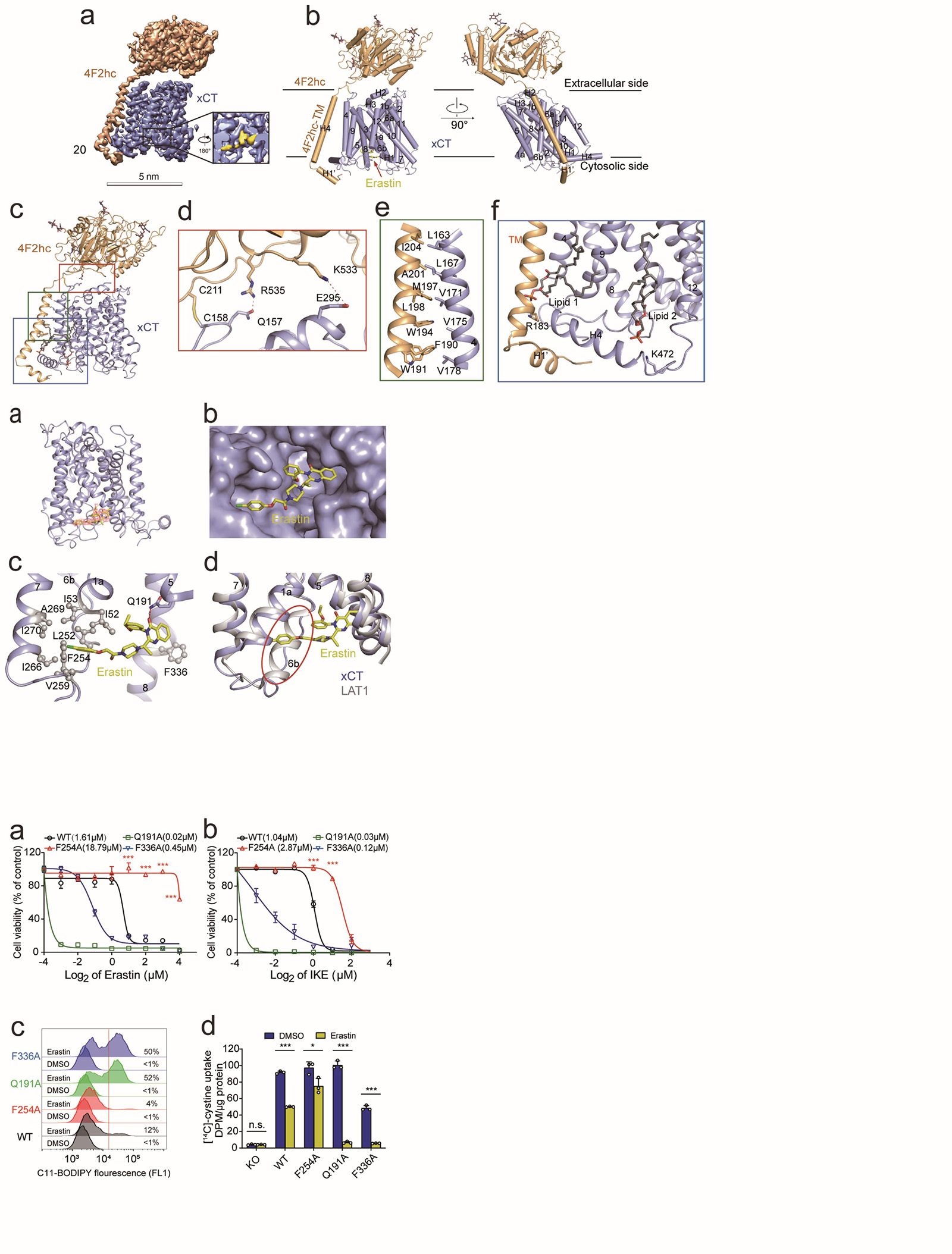
图5 Erastin与xCT互作的详细结构
此外,基于以上结构信息,研究人员进行了erastin升级版抑制剂IKE(Imidazole Ketone Erastin)【7】与xCT的分子模拟对接,发现IKE 与erastin 锚定在xCT上的同一个口袋中(图6)。
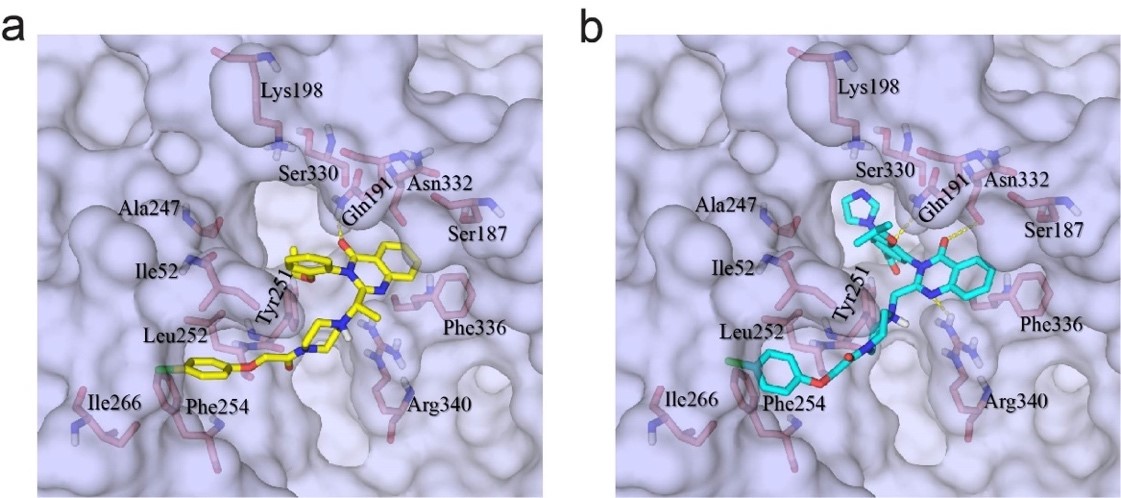
图6 预测IKE与xCT结合
为了验证和确认Erastin与xCT相互作用的位点,研究人员又开展了功能实验。利用野生型(wt)或xCT敲除的人纤维肉瘤HT-1080细胞,分别构建稳定过表达Q191A、F254A或F336A突变的xCT细胞株。发现,当xCT第254位苯丙氨酸突变成丙氨酸(F254A)后,相对于野生型xCT,细胞变得更加抵抗erastin或IKE诱导的铁死亡(图7.a-b),其脂质过氧化水平也明显降低(图7.c)。
同位素碳14标记的胱氨酸底物转运活性实验来检测上述三个突变对xCT功能的影响。同样发现,当xCT第254位苯丙氨酸突变成丙氨酸(F254A)后,相对于野生型xCT,在较低浓度erastin处理后,其底物转运活性抑制率降低(图7.d)。进一步证明了Phe254对erastin结合xCT发挥重要作用。
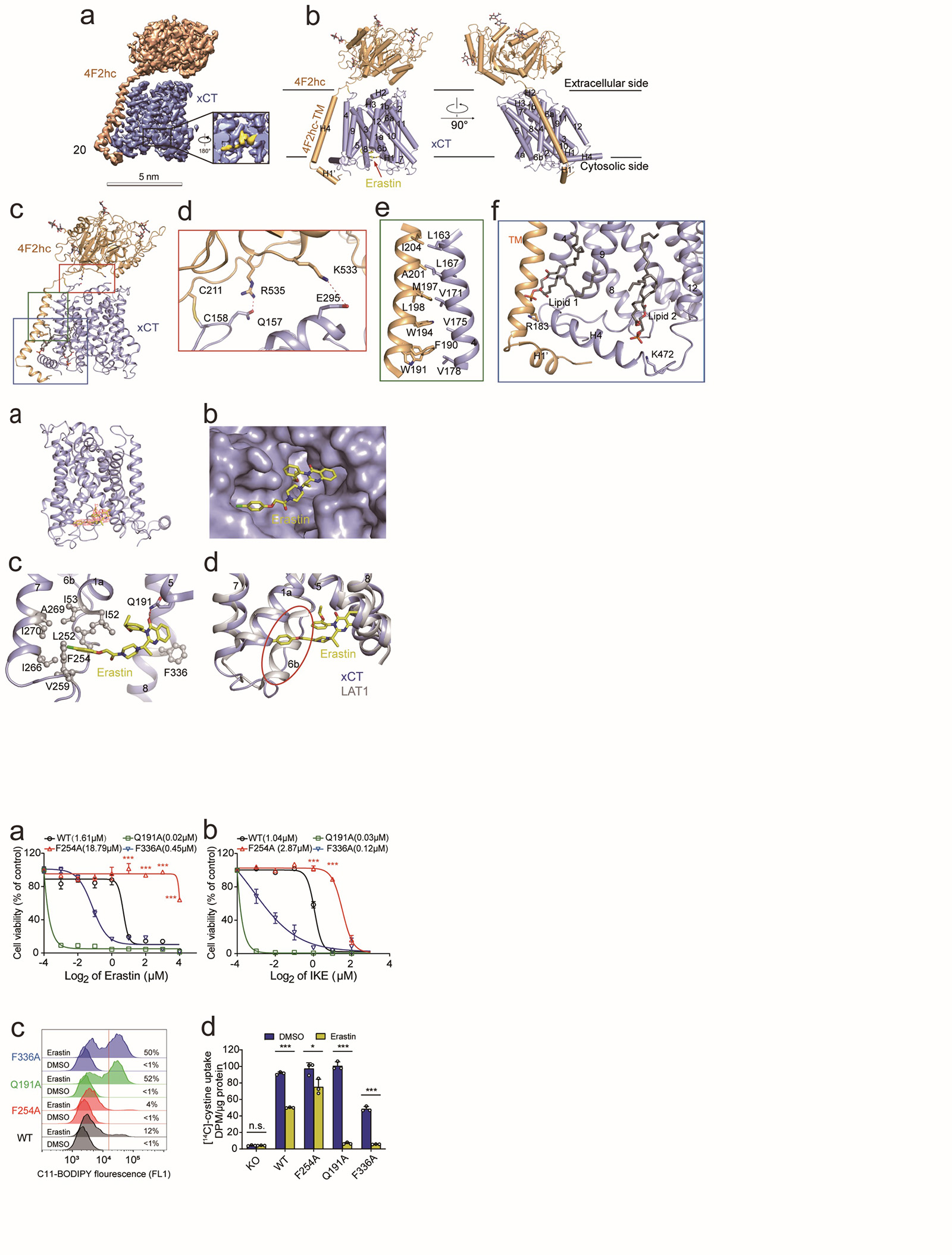
图7部分功能验证的细胞实验结果
总之,该研究成功解析了Erastin与xCT-4F2hc结合的高分辨三维结构,为设计和寻找更加特异xCT抑制剂以及铁死亡激活剂提供了蛋白结构基础数据,为靶向xCT治疗癌症等重大疾病提供了重要参考。
西湖大学博士后鄢仁鸿(现为南方科技大学助理教授)、浙江大学博士生谢恩军、清华大学博士生李雅宁和浙江大学博士后李瑾(现为杭州师范大学助理研究员)为论文的共同第一作者;浙江大学王福俤教授、西湖大学周强研究员和浙江大学闵军霞教授为共同通讯作者。
王福俤/闵军霞教授团队及周强研究员团队的其他多位老师同学、浙江大学药学院侯廷军教授团队和美国哥伦比亚大学Brent R. Stockwell教授也为本工作作出了贡献。本研究得到了国家重点研发计划项目和国家自然科学基金项目资助支持。西湖大学冷冻电镜中心和高性能计算中心、浙江大学医学院公共技术平台、浙江大学核农业科学研究所提供了实验支持。
铁死亡与重大疾病防治是王福俤/闵军霞教授团队重要研究方向之一,近期代表性成果如下:
王福俤/闵军霞团队首次利用多种铁过载性基因敲除小鼠模型发现并阐明铁死亡是铁过载诱发血色病消暑肝脏损伤的重要致病机制。成果以封面论文形式发表在Hepatology;论文题目为:“Characterization of ferroptosis in murine models of hemochromatosis”(高被引论文)【8】。
王福俤/闵军霞团队首次揭示铁死亡在心脏疾病发生发展中的重要作用、调控机制以及疾病靶点的重大意义。成果发表在著名学术期刊Proceedings of The National Academy Of Sciences USA;论文题目为:“Ferroptosis as a target for protection against cardiomyopathy”(高被引和热点论文)【9】。
王福俤/闵军霞团队系统阐明了铁过载状态下铁蛋白(Ferritin)抑制心脏铁死亡的生理效应并首次揭示了铁死亡关键调控蛋白Slc7a11在心脏疾病中的重要作用和转化潜力。成果发表在著名学术期刊Circulation Research。论文题目为“Loss of cardiac Ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis” 【10】。
王福俤/闵军霞团队发现药物金诺芬通过抑制硫氧还蛋白还原酶TXNRD导致细胞膜脂质过氧化累积,并最终引发铁死亡。该成果首次将TXNRD蛋白引入到铁死亡调控网络。这也是全球建立的第一个铁死亡肝损伤模型——金诺芬诱导模型。成果发表在著名学术期刊Signal Transduction and Targeted Therapy。论文题目为“Auranofin mitigates systemic iron overload and induces ferroptosis via distinct mechanisms” 【11】。
王福俤/闵军霞团队首次揭示并阐明转铁蛋白通过调控铁死亡抑制肝脏纤维化发生的分子机制;并首次利用动物模型展示肝脏的金属离子转运蛋白Slc39a14通过吸收非转铁蛋白结合铁而诱发肝实质细胞铁死亡,进而导致肝脏纤维化的发生,有望成为肝脏纤维化防止的新靶点。成果以封面论文形式发表在著名学术期刊Blood。论文题目为 “Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis”(高被引论文)【12】。
王福俤/闵军霞团队国际权威学术期刊Blood发表题为“RNF217 regulates iron homeostasis through its E3 ubiquitin ligase activity by modulating ferroportin degradation”的封面研究论文【13】。首次阐明了铁泵蛋白(Ferroportin,FPN)在体内外被降解的调控机制。同期配发亮点评述。
王福俤团队联合苏州大学罗承良团队,2020年11月在国际著名学术期刊Journal of Pineal Research(影响因子:14.528)在线合作发表题为“Deletion of ferritin H in neurons counteracts the protective effect of melatonin against traumatic brain injury-induced ferroptosis”的研究论文【14】。该成果首先系统阐明了脑外伤后铁死亡相关蛋白表达与铁沉积的时程变化规律;首次在脑外伤动物模型上揭示了褪黑素是一种潜在的铁死亡抑制剂,阐明了褪黑素在治疗脑外伤中的新机制,其抗铁死亡作用有望成为脑损伤治疗的新靶点。
王福俤团队联合暨南大学鞠振宇团队2021年7月在Cell Death & Disease杂志发表了题为GPX4 and vitamin E cooperatively protect hematopoietic stem and progenitor cells from lipid peroxidation and ferroptosis的研究论文【15】。该研究首次报道了干细胞的铁死亡,发现GPX4和维生素E共同保护造血干祖细胞,抑制脂质过氧化,防止铁死亡发生,维持造血系统稳定。
王福俤团队联合南方医科大学马强团队,2022年3月在Journal of Cachexia, Sarcopenia and Muscle(JCSM,影响因子12.9)发表题为“ACSL4 contributes to ferroptosis-mediated rhabdomyolysis in exertional heat stroke”研究论文【16】。该成果揭示铁死亡是劳力型热射病横纹肌溶解症重要发病机制;ACSL4在促进骨骼肌细胞铁死亡过程中发挥关键作用;Hippo通路下游效应因子YAP/TEAD1/TEAD4调控ACSL4转录表达,进而诱导骨骼肌发生铁死亡。
王福俤/闵军霞团队联合广东省微生物研究所谢黎炜团队,2020年4月在国际著名学术期刊Advanced Science发表题为“Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes”的研究论文【17】,系统阐明Tfr1通过特异机制调控棕色/米色脂肪细胞产热和分化,即在米色脂肪细胞上,活化的缺氧诱导因子HIF1α通过转录调控Tfr1表达促进铁吸收从而维持线粒体功能;在棕色脂肪细胞上,Tfr1可能以铁依赖方式控制细胞产热,以非铁依赖方式调控细胞转分化。
王福俤团队联合厦门大学刘刚和毛景松团队,2021年12月在Science旗下子刊Science Advances在线发表研究成果“Repurposing ICG enables MR/PA imaging signal amplification and iron depletion for iron-overload disorders”【18】。该研究首次报道了临床常用肝功能检测及手术导航制剂吲哚菁绿(ICG)可作为磁共振对比剂和去铁剂用于铁过载疾病诊疗一体化新策略。
王福俤/闵军霞团队系统总结了铁死亡在肝脏疾病研究最新进展,提出靶向铁死亡诊治肝脏疾病的新策略,并讨论领域未来发展方向。综述发表在国际著名学术期刊Cell Death & Differentiation。论文题目为 “The multifaceted role of ferroptosis in liver disease”【5】。另外,还受邀为Signal Transduction and Targeted Therapy、Science Bulletin(2篇)和Liver International等著名专业学术期刊撰写综述和评述。
溶质转运蛋白的结构和功能研究是周强课题组的主要研究方向之一。
周强课题组在异源多聚体氨基酸转运蛋白SLC7家族和SLC3家族的结构和功能方面进行了广泛且深入的研究。周强课题组首次解析了人源异源多聚体氨基酸转运蛋白LAT1-4F2hc复合物的三维结构。LAT1-4F2hc复合物被认为是重要的抗癌药物靶点, 近年来备受制药界的关注。其三维结构的解析为理性设计全新靶向抗癌药物提供了关键的结构基础,具有重大的科学意义和应用价值。该项研究成果于2019年3月在Nature杂志发表【6】。
周强课题组解析了人源氨基酸转运蛋白b0,+AT-rBAT复合物的三维结构,揭开了胱氨酸尿症发病的分子机理,为可能的治疗方案提供了线索。该项工作2020年4月发表在Science Advances杂志上【19】。
周强课题组解析了LAT2-4F2hc复合物的三维结构,揭开了底物识别和结合的机制,为深入理解氨基酸转运蛋白的工作机制提供了结构基础。该项工作2020年11月发表在Cell Discovery杂志上【20】。
周强课题组在人源LAT1-4F2hc复合物氨基酸转运蛋白的研究方面与瑞士苏黎世联邦理工学院的Karl-Heinz Altmann教授围绕LAT1的小分子抑制剂的作用机制展开合作。周强课题组通过冷冻电镜技术解析了多种抑制剂结合状态下的LAT1-4F2hc复合物三维结构,发现了两种新构象,为未来设计更加强效的靶向肿瘤氨基酸代谢的抗癌药物提供了重要线索。该研究工作于2021年3月24日在Cell Discovery杂志上在线发表【21】。
专家点评
甘波谊教授 (美国MD安德森癌症中心, 辐射和癌症代谢研究中心主任)
铁死亡(ferroptosis)是铁离子依赖,由细胞膜上脂质过氧化 (lipid peroxidation) 过度发生而引起的一种细胞死亡方式。由于铁死亡与其他被大家熟知的细胞死亡方式, 比如细胞凋亡 (apoptosis), 在机制原理上有基本的不同, 以及其与各种疾病的密切相关性, 铁死亡在近年成为国际生物医学研究的热点之一。对铁死亡的研究起源于美国哥伦比亚大学的Brent Stockwell教授和他的团队对一个叫erastin的小分子药物的多年探索。Stockwell团队于2012年在Cell杂志上报道, erastin可以通过抑制system Xc- (Xc- 系统)介导的胱氨酸转入 (cystine import) 从而诱导一种铁离子依赖的细胞死亡 (这也是铁死亡名称的由来; 我们现在知道这是因为脂质过氧化的化学反应依赖于芬顿反应 [Fenton reactions])。Xc-系统是一种对向氨基酸转运复合物 (antiporter) , 由两个亚基组成, 包括转运体亚基SLC7A11 (又称为xCT)和调控亚基SLC3A2 (又称为4F2hc)。SLC7A11 向细胞内转入胱氨酸同时向细胞外转出谷氨酸, 而SLC3A2对SLC7A11的蛋白稳定性和亚细胞定位起重要作用。进入细胞质的胱氨酸被迅速还原成半胱氨酸,后者被用于合成谷胱甘肽(GSH), 而谷胱甘肽作为GPX4的重要辅因子然后被用来还原细胞膜上积累的脂质过氧化物从而抑制铁死亡。这条system Xc- -GSH-GPX4通路是细胞里最重要的抵御铁死亡的机制。而当erastin把Xc- 系统介导的胱氨酸转入给阻断后, 铁死亡抵御系统的崩溃导致细胞膜上的脂质过氧化物过度积累从而最终引发铁死亡。
Erastin是研究中最为广泛使用的铁死亡诱导剂 (ferroptosis inducer), 并且erastin和它的类似物(比如IKE)作为铁死亡诱导剂有成为新型抗癌药物的巨大潜力, 但是Eastin是如何抑制(包括是直接还是间接抑制)Xc- 系统的分子机制一直是个谜。在铁死亡发现的十周年之际, 最近由王福俤教授、周强研究员和闵军霞教授团队合作在Cell Research发表的这篇大作, 通过冷冻电镜解析了Erastin如何直接结合Xc- 系统 (SLC7A11-SLC3A2复合物) 从而最终解开了这个谜。这项研究有两个重要意义。从转化研究的意义上讲,这个结构解析有助于以后设计更好更强效的SLC7A11抑制剂从而研发新型抗癌药物。从基础研究的意义上讲,作者通过结构解析找到SLC7A11上和Erastin结合的确切氨基酸。将这些SLC7A11上的相关氨基酸突变导致表达SLC7A11突变体的细胞对Erastin 有明显抗性。这些SLC7A11突变体作为重要的研究工具可用于以后铁死亡的机制研究中。需要说明的是,虽然表达SLC7A11突变体的细胞相比于表达SLC7A11野生型的细胞对Erastin诱导的铁死亡有明显抗性,但是并不对Erastin有完全抗性,提示Erastin可以通过独立于SLC7A11以外的机制诱导铁死亡,从而为以后的铁死亡研究提出新问题。
张岩教授(长江学者,浙江大学医学院生物物理学系,基础医学院副院长)
铁死亡作为一种新型独特的程序性死亡方式,在过去的十年中逐步被科学界所熟悉并探究。目前已报道铁死亡参与诸多生理病理过程,包括神经退行性疾病、肝纤维化、心肌病、恶性肿瘤、自身免疫性疾病等,提示我们可以通过调控铁死亡来干预治疗这些疾病。研究发现system Xc--谷胱甘肽(GSH)-GPX4作为关键调控通路在铁死亡发生发展中发挥重要作用。其中system Xc-是位于膜上的胱氨酸和谷氨酸反向转运通道,已发现在多种肿瘤中高表达,抑制system Xc-可以抑制肿瘤生长。而小分子铁死亡激活剂Erastin就是通过抑制xCT发挥作用的,但由于其生物利用度率低及非特异性作用等原因,限制了其临床转化,只被广泛应用在铁死亡细胞生物学实验中。解析Erastin与system Xc-作用的结构基础及开发选择性的system Xc-抑制剂是亟待解决的科学问题。
近日,闵军霞教授/王福俤教授/周强研究员合作解析了xCT与4F2hc蛋白复合物的高分辨率冷冻电镜结构,首次清晰地观察到Erastin结合到xCT的空间结构信息。该创新成果发现,Erastin一端的氯苯氧基延伸到由xCT的TM1a、TM6b 和 TM7 排列组成的疏水口袋中,其苯环还和TM6b中的第254位苯丙氨酸相互作用,以上识别机制对于Erastin结合xCT并抑制其转运功能发挥重要作用。该研究为困扰科学领域十年难题“Erastin抑制xCT从而激活铁死亡机制”寻得了答案,是铁死亡研究十周年的里程式学术成果。该成果为靶向system Xc-的药物研发奠定了坚实生物学基础;相信该成果将为推动铁死亡基础研究及转化研究再上一个台阶发挥不可或缺的重要作用。
参考文献
[1] Renhong Yan#, Enjun Xie#, Yaning Li#, Jin Li#, Yuanyuan Zhang, Ximin Chi, Xueping Hu, Lei Xu, Tingjun Hou, Brent R. Stockwell, Junxia Min*, Qiang Zhou*, Fudi Wang*. The structure of erastin-bound xCT-4F2hc complex reveals molecular mechanisms underlying erastin induced ferroptosis. Cell Research, 2022; Doi: 0.1038/s41422-022-00642-w
[2] Scott J. Dixon, Kathryn M. Lemberg, Michael R. Lamprecht, Rachid Skouta, Eleina M. Zaitsev, Caroline E. Gleason, Darpan N. Patel, Andras J. Bauer, Alexandra M. Cantley, Wan Seok Yang, Barclay Morrison III, Brent R. Stockwell*. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012; 149(5):1060-72. doi: 10.1016/j.cell.2012.03.042.
[3] Xuejun Jiang*, Brent R. Stockwell*, Marcus Conrad*. Ferroptosis: mechanisms, biology and role in disease. Nature Reviews Molecular Cell Biology, 2021; 22(4):266-282. doi: 10.1038/s41580-020-00324-8. Epub 2021 Jan 25.
[4] Pranavi Koppula, Li Zhuang, Boyi Gan*. Cystine transporter SLC7A11/xCT in cancer: ferroptosis, nutrient dependency, and cancer therapy. Protein Cell, 2021; 12(8):599-620. doi: 10.1007/s13238-020-00789-5. Epub 2020 Oct 1.
[5] Junyi Chen#, Xiaopeng Li#, Chaodong Ge#, Junxia Min*, Fudi Wang*. The multifaceted role of ferroptosis in liver disease. Cell Death & Differentiation, 2022; doi: 10.1038/s41418-022-00941-0.
[6] Renhong Yan#, Xin Zhao#, Jianlin Lei, Qiang Zhou*. Structure of the human LAT1-4F2hc heteromeric amino acid transporter complex. Nature, 2019; 568(7750):127-130. doi: 10.1038/s41586-019-1011-z. Epub 2019 Mar 13.
[7] Yan Zhang, Hui Tan, Jacob D. Daniels, Fereshteh Zandkarimi, Hengrui Liu, Lewis M. Brown, Koji Uchida, Owen A. O’Connor, Brent R. Stockwell*. Imidazole Ketone Erastin Induces Ferroptosis and Slows Tumor Growth in a Mouse Lymphoma Model. Cell Chemical Biology, 2019; 26(5):623-633.e9. doi: 10.1016/j.chembiol.2019.01.008. Epub 2019 Feb 21.
[8] Hao Wang, Peng An, Enjun Xie, Qian Wu, Xuexian Fang, Hong Gao, Zhuzhen Zhang, Yuzhu Li, Xudong Wang, Jiaying Zhang, Guoli Li, Lei Yang, Wei Liu, Junxia Min*, Fudi Wang*. Characterization of ferroptosis in murine models of hemochromatosis. Hepatology, 2017; 66(2):449-465. doi: 10.1002/hep.29117. Epub 2017 May 16.
[9] Xuexian Fang, Hao Wang, Dan Han, Enjun Xie, Xiang Yang, Jiayu Wei, Shanshan Gu, Feng Gao, Nali Zhu, Xiangju Yin, Qi Cheng, Pan Zhang, Wei Dai, Jinghai Chen, Fuquan Yang, Huang-Tian Yang, Andreas Linkermann*, Wei Gu*, Junxia Min*,Fudi Wang*. Ferroptosis as a target for protection against cardiomyopathy. PNAS, 2019; 116(7):2672-2680.
[10] Xuexian Fang , Zhaoxian Cai, Hao Wang, Dan Han, Qi Cheng, Pan Zhang, Feng Gao, Yingying Yu, Zijun Song, Qian Wu, Peng An, Sicong Huang, Jianwei Pan, Hou-Zao Chen, Jinghai Chen, Andreas Linkermann, Junxia Min*, Fudi Wang*. Loss of cardiac Ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis. Circulation Research, 2020; 127(4):486-501.
[11] Lei Yang #, Hao Wang #, Xiang Yang #, Qian Wu, Peng An, Xi Jin, Weiwei Liu, Xin Huang, Yuzhu Li, Shiyu Yan, Shuying Shen, Tingbo Liang*, Junxia Min*, Fudi Wang*. Auranofin mitigates systemic iron overload and induces ferroptosis via distinct mechanisms. Signal Transduction and Targeted Therapy, 2020; 5(1):138. doi: 10.1038/s41392-020-00253-0.
[12] Yingying Yu#, Li Jiang#, Hao Wang, Zhe Shen, Qi Cheng, Pan Zhang, Jiaming Wang, Qian Wu, Xuexian Fang, Lingyan Duan, Shufen Wang, Kai Wang, Peng An, Tuo Shao, Raymond T Chung, Shusen Zheng*, Junxia Min*, Fudi Wang*. Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis. Blood, 2020; 136(6), 726–739.
[13] Li Jiang#, Jiaming Wang#, Kai Wang, Hao Wang, Qian Wu, Cong Yang, Yingying Yu, Pu Ni, Yueyang Zhong, Zijun Song, Enjun Xie, Ronggui Hu, Junxia Min*, Fudi Wang*. RNF217 regulates iron homeostasis through its E3 ubiquitin ligase activity by modulating ferroportin degradation. Blood, 2021;138 (8): 689–705; doi: 10.1182/blood.2020008986
[14] Tongyu Rui#, Haochen Wang#, Qianqian Li#, Ying Cheng, Yuan Gao, Xuexian Fang, Xuying M , Guang Chen, Cheng Gao, Zhiya Gu , Shunchen Song, Jian Zhang, Chunling Wang, Zufeng Wang, Tao Wang, Mingyang Zhang, Junxia Min, Xiping Chen, Luyang Tao*, Fudi Wang*, Chengliang Luo*. Deletion of ferritin H in neurons counteracts the protective effect of melatonin against traumatic brain injury-induced ferroptosis. Journal of Pineal Research. 2021 Mar;70(2):e12704. doi: 10.1111/jpi.12704.
[15] Qian Hu, Yifan Zhang, Huiling Lou, Zexian Ou, Jin Liu, Wentao Duan, Hao Wang, Yuanlong Ge, Junxia Min, Fudi Wang* , Zhenyu Ju*. GPX4 and vitamin E cooperatively protect hematopoietic stem and progenitor cells from lipid peroxidation and ferroptosis. Cell Death & Disease. 2021 Jul 15;12(7):706. doi: 10.1038/s41419-021-04008-9
[16] Sixiao He, Ru Li, Yanmei Peng, Ziqing Wang, Junhao Huang, Hongen Meng, Junxia Min, Fudi Wang(王福俤)*, Qiang Ma(马强)*. ACSL4 contributes to ferroptosis-mediated rhabdomyolysis in exertional heat stroke. J Cachexia Sarcopenia Muscle. 2022 Mar 3. doi: 10.1002/jcsm.12953
[17] Jin Li#, Xiaohan Pan#, Guihua Pan, Zijun Song, Yao He, Susu Zhang, Xueru Ye, Xiang Yang, Enjun Xie, Xinhui Wang, Xudong Mai, Xiangju Yin, Biyao Tang, Xuan Shu, Pengyu Chen, Xiaoshuang Dai, Ye Tian, Liheng Yao, Mulan Han, Guohuan Xu, Huijie Zhang, Jia Sun, Hong Chen, Fudi Wang*, Junxia Min* and Liwei Xie*. Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes. Advanced Science. 2020 Apr 24;7(12):1903366. doi: 10.1002/advs.201903366
[18] Huirong Lin#, Yu Zhou#, Jiaming Wang, Huimeng Wang, Tianhong Yao , Hu Chen, Huili Zheng, Yang Zhang, En Ren, Lai Jiang, Chengchao Chu, Xiaoyuan Chen, Jingsong Mao*, Fudi Wang*, Gang Liu*. Repurposing ICG enables MR/PA imaging signal amplification and iron depletion for iron-overload disorders. Science Advances. 2021 Dec 17;7(51):eabl5862. doi: 10.1126/sciadv.abl5862.
[19] Renhong Yan #, Yaning Li #, Yi Shi#, Jiayao Zhou, Jianlin Lei, Jing Huang*, Qiang Zhou*. Cryo-EM structure of the human heteromeric amino acid transporter b0,+AT-rBAT. Science Advances. 2020.4.15, 6(16), eaay6379
[20] Renhong Yan#, Jiayao Zhou#, Yaning Li#, Jianlin Lei, Qiang Zhou*. Structural insight into the substrate recognition and transport mechanism of the human LAT2-4F2hc complex. Cell Discovery. 2020 Nov 10;6(1):82. doi:10.1038/s41421-020-00207-4.
[21] Renhong Yan#, Yaning Li#, Jennifer Müller#, Yuanyuan Zhang#, Simon Singer, Lu Xia, Xinyue Zhong, Jürg Gertsch, Karl-Heinz Altmann*, Qiang Zhou*. Mechanism of substrate transport and inhibition of the human LAT1-4F2hc amino acid transporter. Cell Discovery. 2021;7(1):16.
通讯作者简介
闵军霞 浙江大学教授,博导

浙江大学医学院/转化医学研究院教授、博士生导师,肿瘤转化医学研究实验室负责人;曾在美国密苏里大学(哥伦比亚)、哈佛大学医学院及世界顶尖药企Novartis学习和工作。团队以长寿人群队列、基因工程小鼠、肿瘤移植瘤模型及临床大数据多组学等整合技术为依托,开展铁死亡与重大疾病防治、营养代谢与肿瘤防治等肿瘤转化医学研究、人类衰老及长寿机制和新策略研究。已在Nature Medicine、Circulation Research、Advanced Science、Blood、Hepatology及PNAS等国际著名期刊发表80余篇论文。
团队欢迎助理研究员、博士后、科研助理和博士生加盟,有意向请联系junxiamin@zju.edu.cn。
王福俤 教授,博导

团队致力于微量元素代谢及铁死亡基础及转化医学研究。先后在Nature、Nature Genetics、Nature Reviews Cardiology、Blood、Cell Research及PNAS等优秀学术期刊发表160余篇论文(JCR一区100篇),包括10篇封面论文、6篇高被引和1篇热点论文;论文总影响因子1500、他引8000余次、H-index 50。成果被The New England Journal of Medicine和Blood等权威期刊数十次亮点评述或正面引用;多项成果被国际临床指南收录。主编译专著5部;发明专利15项;百余次大会主旨报告及著名大学邀请报告。主持国家自然科学基金杰出青年项目、重点项目(4项)及国家重点研发计划(首席)等项目。国家万人计划(2016-)、国家杰出青年(2012-)、全球前2%顶尖科学家(2020-)和中国生物物理学会生物微量元素分会会长(2018-)等荣誉。
王福俤团队欢迎助理研究员、博士后、科研助理和博士生加盟,有意向请联系fwang@zju.edu.cn。
周强 西湖大学研究员,博导

课题组主要研究与重大疾病或者重要生物学过程相关的复合物和膜蛋白的结构以及工作机制,在新冠病毒入侵细胞机制、人源溶质转运蛋白等方面取得了一系列成果。周强研究员作为通讯作者在Science、Nature、Cell、Cell Research、Cell Discovery等杂志上发表10多篇文章。
周强课题组欢迎助理研究员、博士后、科研助理和博士生加盟,有意向请联系zhouqiang@westlake.edu.cn。


