Nat Commun|孙毅教授课题组发现拟素化修饰调控肿瘤细胞谷氨酰胺吸收和代谢
代谢是细胞及机体生命活动能量与物质来源的基础,其稳态平衡是机体应对内外时空变化的重要保障 [1, 2]。代谢紊乱或调控机制异常与多种人类疾病密切相关,例如,肿瘤代谢异常赋予肿瘤细胞特异性增殖优势,影响和改变肿瘤微环境,促进肿瘤细胞的存活 [3, 4]。因此,揭示代谢途径调控机制,将为包括肿瘤在内的疾病发病机理提供全新突破口,并为其临床靶向预治提供新的策略与手段。
拟素化 (neddylation) 是一种调节蛋白活性或功能但不介导其被26S蛋白酶体降解的蛋白质翻译后修饰 [5]。拟素化过程与泛素化过程类似,通过NEDD8激活酶E1 (NEDD8-activating enzyme, NAE)、NEDD8耦联酶E2 (NEDD8-conjugating enzyme) 和E3连接酶 (E3 ligase) 组成的三联酶促反应将拟素NEDD8与目标蛋白共价结合 [6]。拟素化修饰的生理性底物为Cullin家族蛋白 (共八种,包括CUL1-3,4A,4B,5,7和9), Cullin的拟素化激活Cullin-RING ligase (CRL) E3泛素连接酶 [7]。CRLs是最大的一类泛素连接酶超家族,由Cullin骨架蛋白、RING结构域蛋白 (RBX1或RBX2)、接头蛋白 (adaptor) 和底物识别受体 (substrate receptor) 几个部分组成 [8]。负责细胞内大约20%的经泛素-蛋白酶体信号通路降解蛋白的泛素化。因此,拟素化修饰与蛋白泛素化降解紧密关联。然而,拟素化信号通路如何调控细胞代谢目前仍不清楚。

2022年5月31日,浙江大学医学院附属第二医院肿瘤研究所/浙江大学转化医学研究院孙毅教授团队在Nature Communications 发表题为Neddylation inhibition induces glutamine uptake and metabolism by targeting CRL3SPOP E3 ligase in cancer cells的研究论文。报道了拟素化修饰通过CRL3SPOP E3泛素连接酶调控肿瘤细胞的谷氨酰胺吸收和代谢。
研究人员前期工作发现,使用小分子MLN4924抑制拟素化修饰,可以诱导线粒体从分裂向融合的动力学转换,破坏线粒体功能,并通过激活PKM2促进糖酵解 [9]。非靶向代谢组学研究指出拟素化修饰在整体上显著调控细胞代谢,通过分析细胞代谢通路,发现谷氨酰胺代谢变化最为显著。细胞实验表明,阻断拟素化修饰后,肿瘤细胞谷氨酰胺吸收及其代谢显著增加;且仅有谷氨酰胺转运体ASCT2/SLC1A5水平增高。增高的ASCT2促进细胞谷氨酰胺吸收和其代谢,维持细胞存活。
为明确拟素化修饰抑制后ASCT2累积的机制,研究结合生物信息学和生化实验,发现ASCT2蛋白含有CRL3 E3泛素连接酶中接头蛋白SPOP经典结合基序,SPOP促进ASCT2蛋白的K48连接的多聚泛素化降解,降低其稳定性。有趣的是,SPOP自身的水平也受环境中谷氨酰胺的调节,在剥夺谷氨酰胺后,SPOP不能形式二聚体,触发SPOP的自身泛素化降解,导致其底物ASCT2的累积。在人体乳腺癌肿瘤组织样本中发现,肿瘤组织SPOP低表达而ASCT2高表达,二者呈负相关性,并且SPOP低表达且ASCT2高表达的患者有较差的存活率;另外,从癌旁到癌组织,SPOP表达逐渐降低,而ASCT2表达逐渐增高。靶向代谢组学分析发现,相比癌旁组织,乳腺癌组织中谷氨酰胺浓度降低。进一步说明包括乳腺癌在内的多种肿瘤对谷氨酰胺有较高吸收和代谢,另一方面,肿瘤微环境中谷氨酰胺浓度会重塑谷氨酰胺转运体ASCT2和其调控蛋白SPOP的水平,进一步调节对谷氨酰胺的吸收和代谢。
鉴于抑制拟素化导致的细胞谷氨酰胺吸收和代谢对肿瘤细胞存活有保护作用,为了进一步揭示靶向拟素化通路和细胞谷氨酰胺代谢对肿瘤细胞生长的影响,研究者使用MLN492联合ASCT2抑制剂V-9302,体外细胞实验及体内肿瘤模型实验结果均显示同时靶向拟素化通路和谷氨酰胺吸收可显著抑制肿瘤细胞增殖。研究结果为MLN4924联合用药提出了可行的方案。
孙毅教授团队的周启银博士为论文第一作者。浙江大学孙毅教授和浙江大学医学院附属邵逸夫医院王娴主任医师为论文共同通讯作者。同时,该研究获得了清华大学胡泽平研究员、浙江大学王林波主任医师和金洪传教授的大力支持。
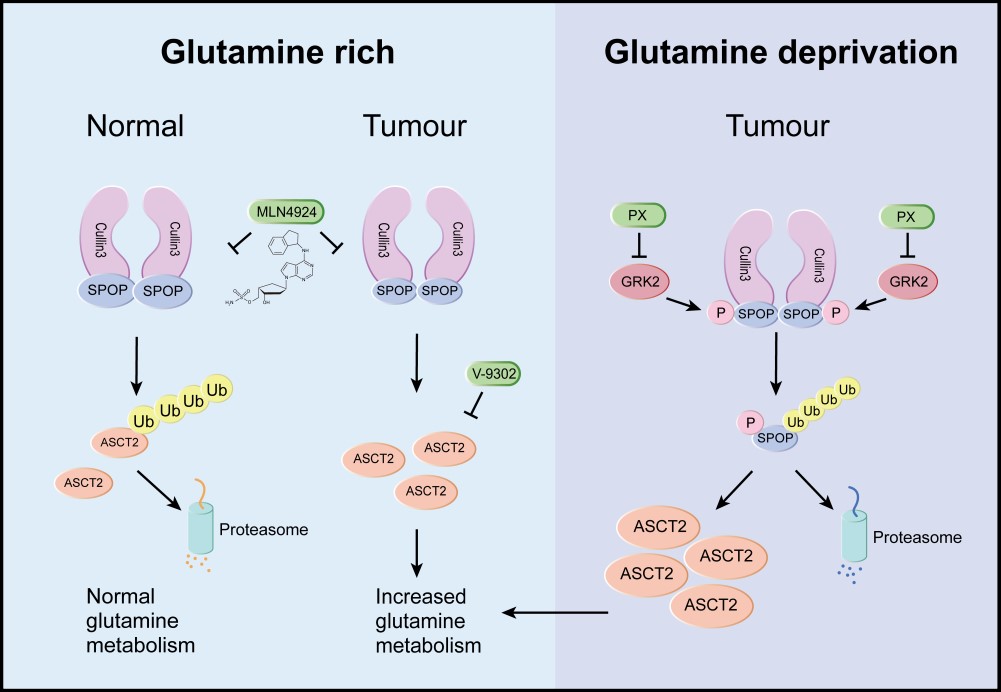
图示:在谷氨酰胺充足条件下,二聚化的SPOP与Cullin 3形成有活性的CRL3-SPOP E3泛素连接酶,促进ASCT2的泛素化降解,维持正常的谷氨酰胺代谢;当肿瘤发生时,由于SPOP突变或者低表达, CRL3-SPOP 泛素连接酶活性减弱,致使ASCT2水平增加,促进谷氨酰胺代谢;在谷氨酰胺匮乏环境中,GRK2被激活,促进SPOP磷酸化,抑制SPOP二聚化并诱发其自身的泛素化,导致底物ASCT2的大量累积,促进谷氨酰胺代谢。
参考文献:
1.Figlia, G., P. Willnow, and A.A. Teleman, Metabolites Regulate Cell Signaling and Growth via Covalent Modification of Proteins. Dev Cell, 2020. 54(2): p. 156-170.
2.Elia, I. and M.C. Haigis, Metabolites and the tumour microenvironment: from cellular mechanisms to systemic metabolism. Nat Metab, 2021. 3(1): p. 21-32.
3.Ghosh-Choudhary, S., J. Liu, and T. Finkel, Metabolic Regulation of Cell Fate and Function. Trends Cell Biol, 2020. 30(3): p. 201-212.
4.Pavlova, N.N., J. Zhu, and C.B. Thompson, The hallmarks of cancer metabolism: Still emerging. Cell Metab, 2022. 34(3): p. 355-377.
5.魏文毅,孙毅,曹诚,常智杰,陈策实,陈佺,程金科,冯仁田,高大明,胡荣贵,贾立军,姜天霞,金建平,李汇华,李卫,刘翠花,刘萱,马蕾娜,缪时英,饶枫,商瑜,宋质银,万勇,王恒彬,王平,王占新,吴缅,吴乔,谢旗,谢松波,谢志平,徐平,许执恒,杨波,阳成伟,应美丹,张宏冰,张令强,赵永超,周军,朱军,王琳芳,张宏,王琛,邱小波。类泛素蛋白及其中文命名。科学通报。2018. 63(25): p. 2564-2569。
6.Zhou, L., et al., Protein neddylation and its alterations in human cancers for targeted therapy. Cell Signal, 2018. 44: p. 92-102.
7.Vogl, A.M., et al., Global site-specific neddylation profiling reveals that NEDDylated cofilin regulates actin dynamics. Nat Struct Mol Biol, 2020. 27(2): p. 210-220.
8.Zhao, Y. and Y. Sun, Cullin-RING Ligases as Attractive Anti-cancer Targets. Curr Pharm Des, 2013. 19(18): p. 3215-25.
9.Zhou, Q., et al., Inhibiting neddylation modification alters mitochondrial morphology and reprograms energy metabolism in cancer cells. JCI Insight, 2019. 4(4).


