Cell Death & Differentiation丨陆林宇团队揭示MRN复合物对减数分裂前期DNA双链断裂修复至关重要
DNA双链断裂(DSB)对基因组稳定性构成极大的威胁,在体细胞中主要通过两种途径修复:同源重组(HR)和非同源末端连接(NHEJ)。然而,在哺乳动物生殖细胞减数分裂前期,SPO11蛋白程序性地在基因组上切割产生大量DSB,并共价连接在DSB的5’末端,形成特殊的SPO11连接的DSB。为促进同源染色体的交叉互换并严格维持生殖细胞的基因组稳定性,这些DSB完全由HR途径修复。在体细胞中,MRN复合物通过末端切除促进DSB的HR修复。然而,尚不清楚MRN复合物是否在哺乳动物生殖细胞减数分裂前期促进SPO11连接的DSB的HR修复。
2020年1月21日,浙江大学转化医学研究院/医学院附属妇产科医院陆林宇课题组在Cell Death & Differentiation杂志在线发表题为“NBS1 is required for SPO11-linked DNA double-strand break repair in male meiosis”的研究论文,揭示MRN复合物成员NBS1对雄性小鼠减数分裂前期SPO11连接的DSB的HR修复至关重要。
通过在体细胞中用TOP2连接的DSB模拟减数分裂前期SPO11连接的DSB,研究人员发现,依赖TDP2的NHEJ途径对TOP2连接的DSB的修复起主要作用,而依赖MRN复合物的HR途径起协同作用。然而,通过在小鼠生殖细胞中特异敲除NBS1,研究人员发现依赖MRN复合物的HR途径在减数分裂前期对于修复SPO11连接的 DSB至关重要。NBS1敲除后,精母细胞减数分裂前期SPO11连接的 DSB的末端切除效率显著下降,HR修复出现明显缺陷,同源染色体不能有效联会并出现异常结构,最终导致减数分裂停滞和雄性不育。此外,研究人员还发现,虽然体细胞中NBS1在DSB位点的募集依赖磷酸化的MDC1,但NBS1在减数分裂前期SPO11连接的 DSB位点的募集并不受MDC1调控,而是依赖另一未知的磷酸化蛋白。这一发现提示减数分裂前期的DSB修复有着独特的调控机制。
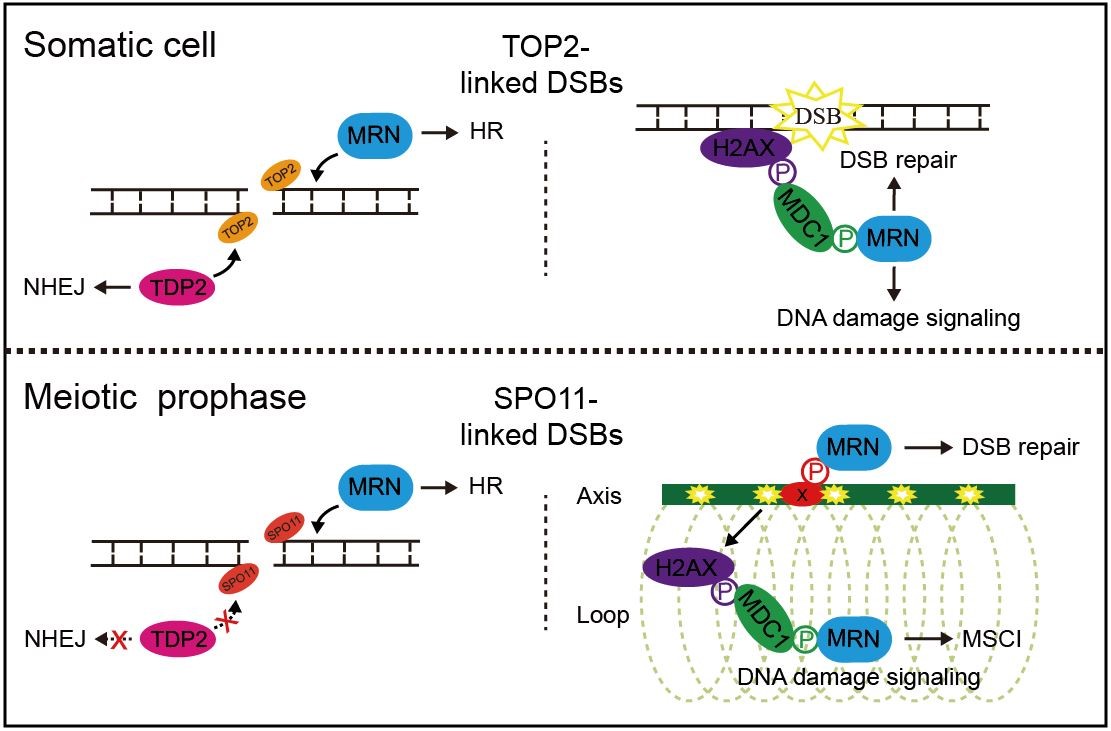
图1:MRN复合物在体细胞中和减数分裂前期参与蛋白连接的DSB修复的模型
论文第一作者是陆林宇课题组的2017级博士研究生张斌,陆林宇课题组的科研助理唐正辉与浙江大学医学院附属妇产科医院的主治医师李乐军参与了部分工作,陆林宇教授为论文通讯作者。该研究项目得到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金的资助。
论文链接:https://www.nature.com/articles/s41418-020-0493-4


