EBioMedicine丨梁平/孙宁团队合作发现转录因子E2A参与调控胚胎干细胞来源的窦房结样细胞的分化
心脏是胚胎发育过程中第一个形成并发挥作用的组织器官。伴随着心脏的形成,传导系统同时协调发展和成熟,并确保起搏电位和动作电位的传播,维持着规律性的心跳。然而心脏传导系统先天性发育异常、衰老以及遗传基因的缺陷会导致心律失常、心脏传导阻滞和病态窦房结综合征等心脏疾患,严重者可发生死亡,对人类健康危害极大。厘清起搏细胞分化的调控机制能够帮助理解起搏细胞紊乱的原因,并提供开发生物起搏器的种子细胞,具有重要的理论和临床意义。
近日,浙江大学转化医学研究院梁平教授团队/复旦大学孙宁教授团队在《柳叶刀(Lancet)》子刊EBioMedicine上发表题为E2A ablation enhances proportion of nodal-like cardiomyocytes in cardiac-specific differentiation of human embryonic stem cells的研究论文。研究者发现转录因子E2A参与调控胚胎干细胞来源的窦房结样细胞的分化。
转录因子E2A是一种广泛分布的E蛋白,可通过HLH结构域形成同源/异源二聚体进而发挥调节作用,其在造血干细胞分化成熟、神经发生、肌组织生成及癌症发生等多个方向均有参与。研究人员发现在转录因子E2A敲除后,人胚胎干细胞(hESC)来源的心肌细胞呈现收缩频率增加、细胞体积减少、收缩力减弱、特异性离子通道表达增加等窦房结样细胞表型,同时TBX18、TBX5、SHOX2等窦房结细胞分化关键调控因子表达水平显著增多。转录组测序数据表明该窦房结样细胞表达谱与人胚胎12周窦房结组织极为相似,膜片钳及微电极阵列对电生理活性的检测也证明窦房结样细胞比例大幅增加,其可形成多处起搏位点(图1)。进一步研究发现转录因子E2A可能通过调控Notch通路的活性,影响hESC向心肌细胞分化过程中的细胞命运决定(图2)。该研究首次提示转录因子E2A可参与调控窦房结样细胞的生成,为探索起搏细胞紊乱的机制提供了新的思路,也为日后纯化生物起搏器的种子细胞指明了方向。
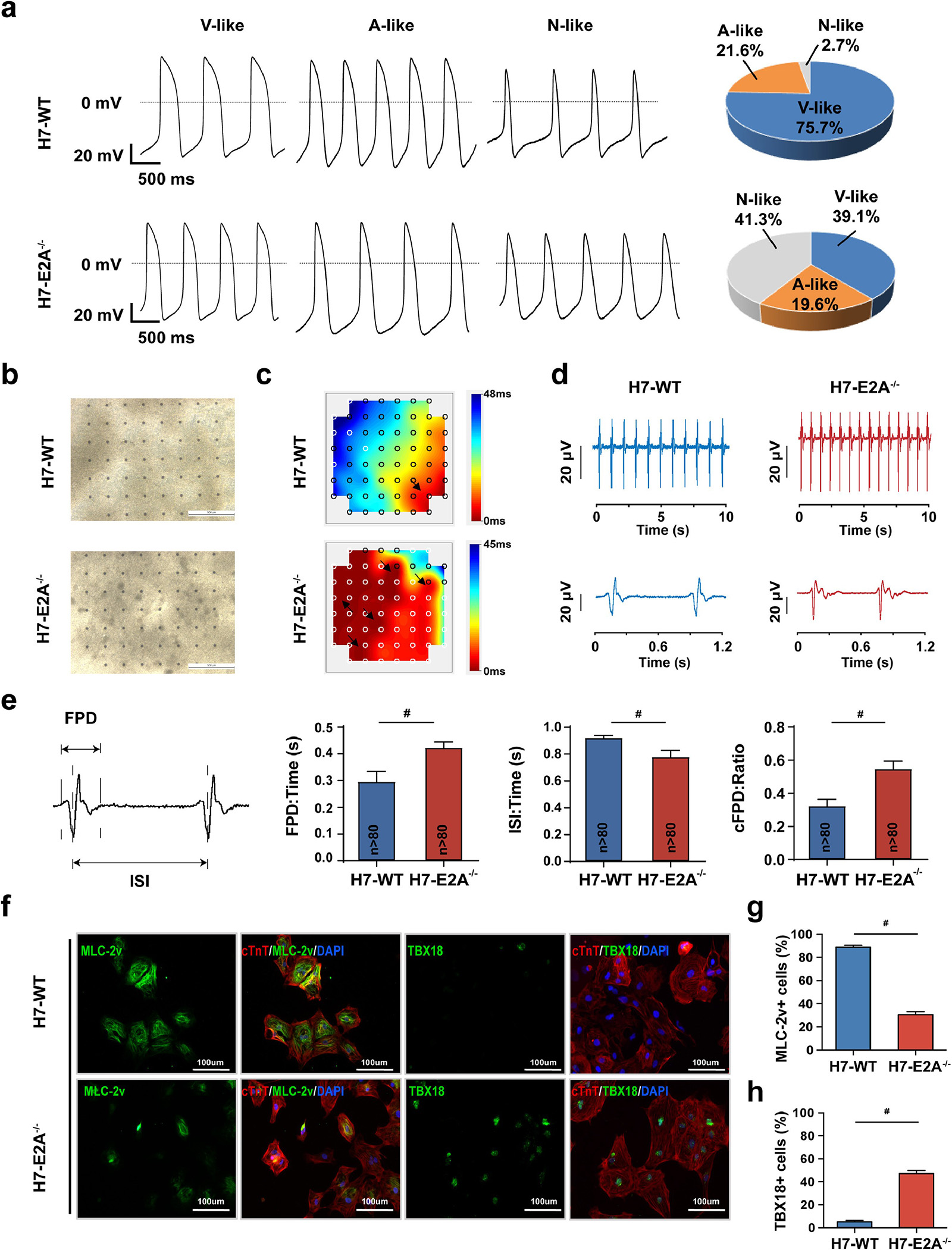
图1. E2A敲除显著上调hESC心肌定向分化中窦房结样细胞比例 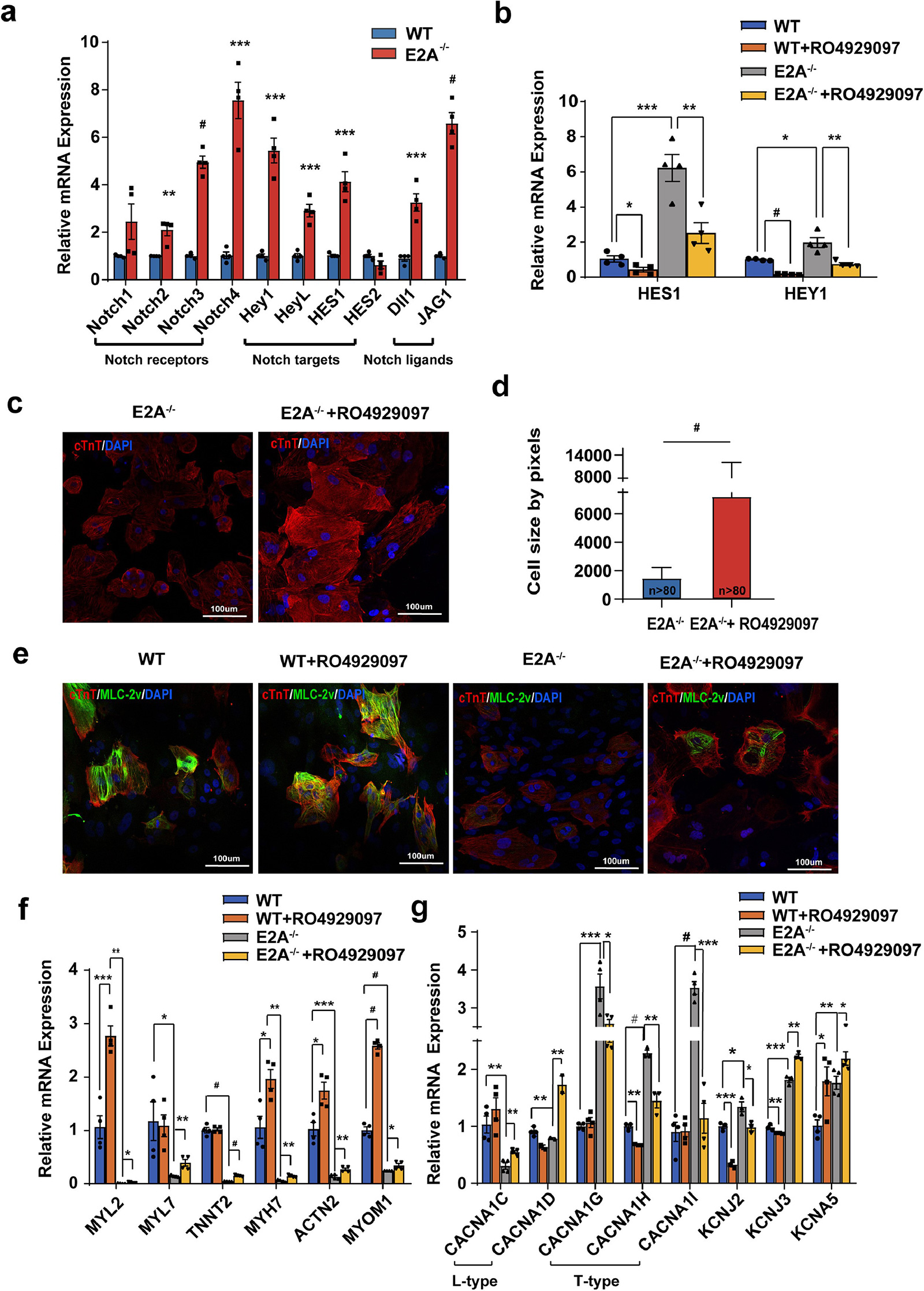
图2. E2A可能通过调控NOTCH信号通路活性影响hESC心肌定向分化的细胞命运决定
复旦大学基础医学院李秀雅博士、郜菲博士、浙江大学转化医学研究院科研助理王晓晨、复旦大学基础医学院梁倩倩青年副研究员为论文的共同第一作者,复旦大学基础医学院孙宁教授、浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平教授、复旦大学基础医学院徐晨讲师为论文的共同通讯作者。
供稿人:徐晨


