Cell Metab | 吕志民/许大千团队发表重要综述:总结代谢酶在癌症等疾病发生发展中的非经典功能
代谢异常是肿瘤和其他疾病的重要特征之一。肿瘤细胞不仅可以调节代谢酶的经典功能来满足自身快速增殖的需要;同时还能通过代谢酶非经典/非代谢(Moonlighting)功能调控多种复杂的细胞活动和疾病的发生发展过程。
2021年1月5日,浙江大学转化医学研究院吕志民/许大千团队 (吕志民教授曾是美国德州大学M.D.安德森癌症中心杰出终身讲席教授和研究成就奖的获得者) 在Cell Metabolism杂志上发表了题为The evolving landscape of noncanonical functions of metabolic enzymes in cancer and other pathologies的长篇综述论文,这是继2018年的Regulation of chromatin and gene expression by metabolic enzymes and metabolites(Nature Reviews Molecular Cell Biology. PMID: 29930302;详见BioArt报道:Nat Rev Mol Cell Bio| 表观遗传学与代谢的交叉)、Metabolic Kinases Moonlighting as Protein Kinases(Trends in Biochemical Sciences. PMID: 29463470)以及近期的Lipid metabolism and cancer(Journal of Experimental Medicine ;详见BioArt报道:JEM综述 | 吕志民等揭示脂质代谢与肿瘤发生发展的相互关系)三篇综述后,吕志民教授对肿瘤代谢新认知和新概念的又一全面总结。该文全面概述了近20年来代谢酶的非经典/非代谢功能在基因表达、细胞周期、DNA损伤修复、细胞增殖、存活、凋亡和肿瘤微环境调控中的重要发现,详尽阐明了代谢酶的非经典功能在癌症等疾病进展中所发挥的作用,深入分析了代谢重编程中具有非经典功能的代谢酶作为治疗新靶点的前景。

1.代谢酶对基因表达的调控
基因转录受染色质结构改变的调控,而染色质结构的改变由DNA甲基化和组蛋白修饰所引起。研究表明,多种位于细胞质或线粒体的代谢酶可以转位至细胞核中,并参与包括甲基化,乙酰化,琥珀酰化,巴豆酰化,磷酸化以及糖基化等在内的组蛋白和DNA的修饰,进而改变染色质结构并调控基因转录。此外,代谢酶还可以通过调节转录因子的功能及其辅助激活因子和mRNA的稳定性来调控基因表达。吕志民教授团队的发现有:(1) 代谢酶可以作为蛋白激酶磷酸化组蛋白:生长因子受体(EGFR,FGFR,PDGFR)的激活可以诱导糖酵解途径中发挥重要作用的丙酮酸激酶M2(PKM2)进入细胞核内,结合并激活β-catenin(Nature, 2011. PMID: 22056988),磷酸化组蛋白H3(Cell,2012. PMID: 22901803;被 Science Signaling评选为 2012年信号转导领域的重大突破),从而促进糖酵解相关基因的表达并增强葡萄糖摄取和乳酸产生 (Warburg效应)(Nature Cell Biology,2012. PMID:23178880; Molecular Cell,2012. PMID:23123196)。(2)代谢酶可以作为蛋白激酶直接参与组蛋白的乙酰化:乙酰辅酶A合成酶2(ACSS2)可转移到核内,在启动子区域产生乙酰辅酶A,并诱导溶酶体合成基因和自噬基因的表达(Molecular Cell, 2017. PMID: 28238651)。(3)代谢酶也可以调控组蛋白的琥珀酰化:α-KGDH结合KAT2A作为组蛋白H3琥珀酰转移酶也可调节基因表达(Nature, 2017. PMID: 29211711)。(4)代谢酶还可作为蛋白激酶控制转录因子的活性:磷酸烯醇式丙酮酸羧基酶1(PCK1)可作为蛋白激酶通过磷酸化INSIG来激活SREBP转录因子以促进脂肪生成相关基因的表达(Nature,2020. PMID: 32322062)。吕教授团队的上述研究揭示了代谢酶的非经典功能可以通过调控基因的转录和翻译影响肿瘤的发生发展。
2.代谢酶对细胞周期进程的调控
DNA复制的起始和完成标志着细胞周期S期的开始和结束。DNA复制由激酶细胞分裂周期7(CDC7)及其调节性激活亚基S期激酶激活剂(ASK)的聚集所启动。在正常细胞中,由CDC7介导的MCM磷酸化产生的ADP与CDC7的变构区结合,破坏CDC7-ASK相互作用的同时,CDC7的活性也受到了抑制。然而,吕教授团队发现,核定位的磷酸甘油酸激酶1(PGK1)可通过催化ADP变成ATP以减轻ADP对CDC7的抑制,进而促进肿瘤细胞的DNA复制(Molecular Cell,2018. PMID: 30392930)。
核苷酸是DNA复制的原料。肿瘤细胞通过促进核苷酸从头合成来维持高效的DNA复制。吕教授团队发现,肝癌细胞会发生果糖激酶(KHK)基因前体mRNA的可变剪接,从与果糖高亲和力的KHK-C转换为低亲和力的KHK-A。而肝癌细胞高表达的KHK-A能够发挥蛋白激酶活性,通过磷酸化并激活磷酸核糖焦磷酸合成酶1(PRPS1)以促进核苷酸的从头合成和肝癌的发生发展(Nature Cell Biology,2016. PMID:2708854)。此外,他们还发现发挥蛋白激酶活性的PKM2除了可以磷酸化组蛋白外,还可以通过磷酸化纺锤体组装蛋白Bub3以调节细胞分裂中期的染色体分离(Molecular Cell, 2014. PMID: 24316223), 通过磷酸化肌球蛋白轻链2(MLC2)以促进胞质分裂(Nature Communications,2014. PMID: 25412762)。
这些发现揭示了肿瘤细胞中代谢酶的非经典功能在细胞周期调控中所发挥的关键作用。
3.代谢酶对DNA损伤修复的调控
代谢酶可参与同源重组(HR)介导的DNA双链断裂(DSB)修复。电离辐射和氧化应激后诱导PKM2的磷酸化及其在核内积累。在细胞核中,PKM2磷酸化CtBP互作蛋白(CtIP),增加了DSB处CtIP的招募和DNA的末端切除,从而促进了HR介导的DNA DSB修复。此外,代谢酶也参与非同源末端连接(NHEJ)DNA修复。吕教授团队发现,电离辐射可诱导DNA依赖性蛋白激酶(DNA-PK)对延胡索酸酶的磷酸化及细胞核易位,与变体组蛋白H2A.Z结合以及在DSB区富集的延胡索酸酶促进了NHEJ DNA修复和细胞存活(Nature Cell Biology, 2015. PMID: 26237645)。
4.代谢酶对细胞增殖,存活,凋亡的调控
吕教授团队发现代谢酶不仅能够直接调控在细胞增殖和存活中起关键作用的信号通路,还可以通过调节细胞自噬,线粒体功能及氧化还原稳态来影响细胞存活和凋亡。吕教授团队发现,磷酸果糖激酶(PFKP)能激活肿瘤细胞中的PI3K,促进肿瘤细胞的增殖(Molecular Cell,2018. PMID: 29677490);在PTEN缺失的肿瘤细胞中,PGK1可作为蛋白激酶进行自磷酸化以增强有氧糖酵解(Warburg效应)(Molecular Cell,2019a. PMID: 31492635);在谷氨酰胺剥夺和缺氧条件下,PGK1可磷酸化Beclin1并激活细胞自噬,以促进肿瘤的发生发展(Molecular Cell,2017a. PMID: 28238651;Molecular Cell,2017b. PMID:28552616);KHK-A作为蛋白激酶,通过磷酸化 p62来激活Nrf2依赖的抗氧化反应 (Science Advances, 2019. PMID: 31032410);KDM3A通过对肿瘤微环境中氧的感知,调节PGC-1α介导的线粒体复制 (Molecular Cell,2019b. PMID:31629659);EGFR受体的激活,低氧或K-RAS G12V/B-Raf V600E的表达可以诱导糖酵解途径中PGK1转入线粒体,PGK1通过磷酸化并激活丙酮酸脱氢酶激酶 1(PDHK1)来抑制线粒体丙酮酸代谢,从而促进了乳酸的产生和肿瘤的生长 (Molecular Cell, 2016. PMID:26942675)。
上述一系列研究揭示代谢酶的非代谢功能可以参与到关键信号通路,自噬,线粒体功能及氧化还原稳态调控等过程,在细胞增殖,存活和凋亡中起着至关重要的作用。
5.代谢酶对肿瘤微环境重塑的调控
PKM2通过调节肿瘤细胞外泌体分泌参与肿瘤微环境的重塑。在代谢酶(如PKM2)过表达的肿瘤细胞中,外泌体和胞外体的分泌得到促进,通过激活受体细胞(例如基质细胞和免疫细胞)转录因子使受体细胞的代谢和转录机制重新编程。
吕志民教授团队对肿瘤细胞能量代谢的研究取得了开创性、系统性的重要成果,已发现多个代谢酶具有蛋白激酶活性(包括代谢酶PKM2、PGK1、KHK-A、PCK1),同时也揭示了若干其他代谢酶具有非经典功能在肿瘤发生发展中的重要作用。上述研究成果极大的丰富了业界对肿瘤代谢的认知。这些开创性的研究不仅为癌症的个体化治疗提供新的代谢标记物和分子靶点,而且对靶向肿瘤代谢的药物研发具有重大的指导意义。
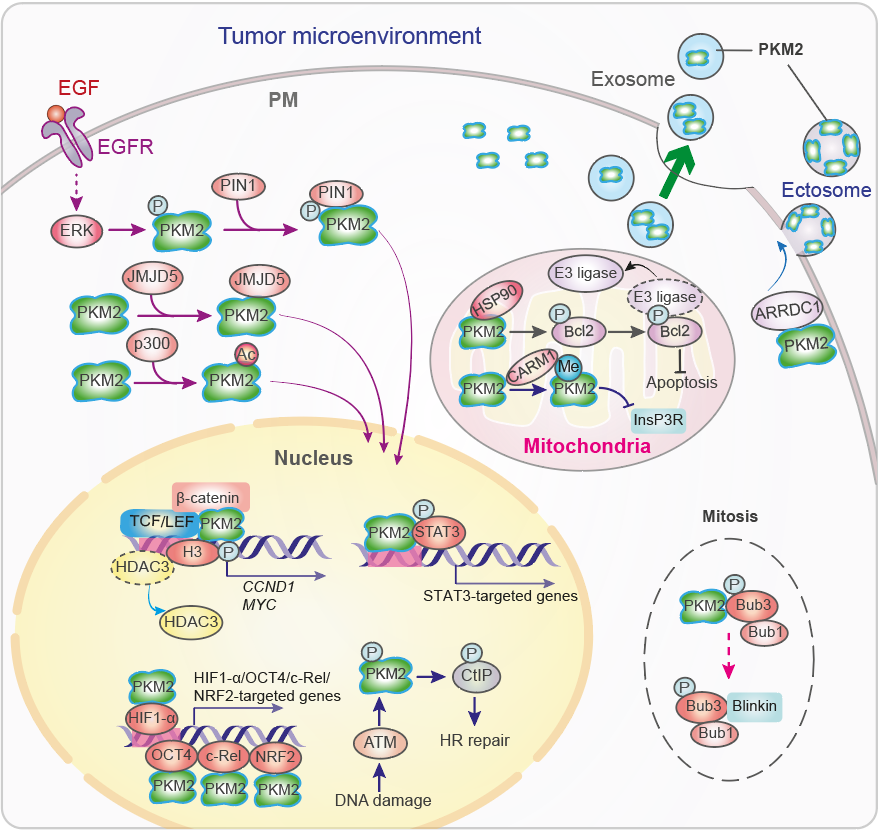
代谢酶PKM2的非经典功能调控网络(摘自综述)


