Cell Death & Differentiation丨陆林宇团队在BRCA1与胚胎发育的研究中取得重要进展
人体内的细胞每天都因为各类外在和内在因素遭受着不同程度的DNA损伤,其中DNA双链断裂是最严重的形式。同源重组(homologous recombination,HR)是精确修复DNA双链断裂重要途径,对维持基因组稳定性至关重要。BRCA1是同源重组修复通路中的关键蛋白,其缺失或突变导致同源重组修复缺陷与基因组不稳定,造成肿瘤易感。除此之外,大多数BRCA1缺失或突变的小鼠胚胎致死,提示BRCA1在胚胎发育中也有着重要的作用。早期研究表明,在某些BRCA1突变小鼠中敲除53BP1可以通过促进DNA双链断裂末端切除恢复同源重组修复效率,继而拯救这些小鼠的胚胎发育障碍。值得注意的是,这些突变小鼠中BRCA1依然存在部分功能。因此,为了进一步解析BRCA1在胚胎发育中的作用,需要研究53BP1敲除是否可以拯救BRCA1完全缺失小鼠的同源重组修复缺陷与胚胎发育障碍。
2020年3月5日,浙江大学转化医学研究院/医学院附属妇产科医院陆林宇课题组在Cell Death & Differentiation杂志发表题为“53BP1 loss rescues embryonic lethality but not genomic instability of BRCA1 total knockout mice”的研究论文。该研究发现,53BP1敲除在同源重组修复缺陷依然存在的情况下可以部分拯救BRCA1完全缺失小鼠的胚胎发育障碍。
研究人员利用BRCA1完全敲除小鼠与53BP1敲除小鼠交配后发现,BRCA1-53BP1 双敲除小鼠部分存活。在BRCA1-53BP1 双敲除的细胞中,同源重组修复缺陷依然存在,细胞对PARP抑制剂存在显著的敏感性。研究人员对存活的BRCA1-53BP1 双敲除小鼠进行追踪观察后发现,所有小鼠均在7个月内死于胸腺淋巴瘤。后续研究发现,由于存在同源重组修复缺陷,BRCA1-53BP1 双敲除的细胞倾向于选择易出错的微同源末端连接这一修复方式对DNA双链断裂进行修复,造成严重的基因组不稳定性,最终导致肿瘤发生。
这项研究揭示了在未能挽救同源重组修复缺陷的情况下,53BP1敲除能够部分拯救BRCA1完全缺失小鼠的胚胎发育障碍。这一发现提示,同源重组修复缺陷并不是BRCA1缺失导致胚胎发育障碍的关键因素,对阐明BRCA1在胚胎发育中的作用具有重要意义。同时,这项研究也表明,53BP1缺失并不会通过恢复同源重组修复效率令BRCA1完全缺失的肿瘤对PARP抑制剂产生耐药。
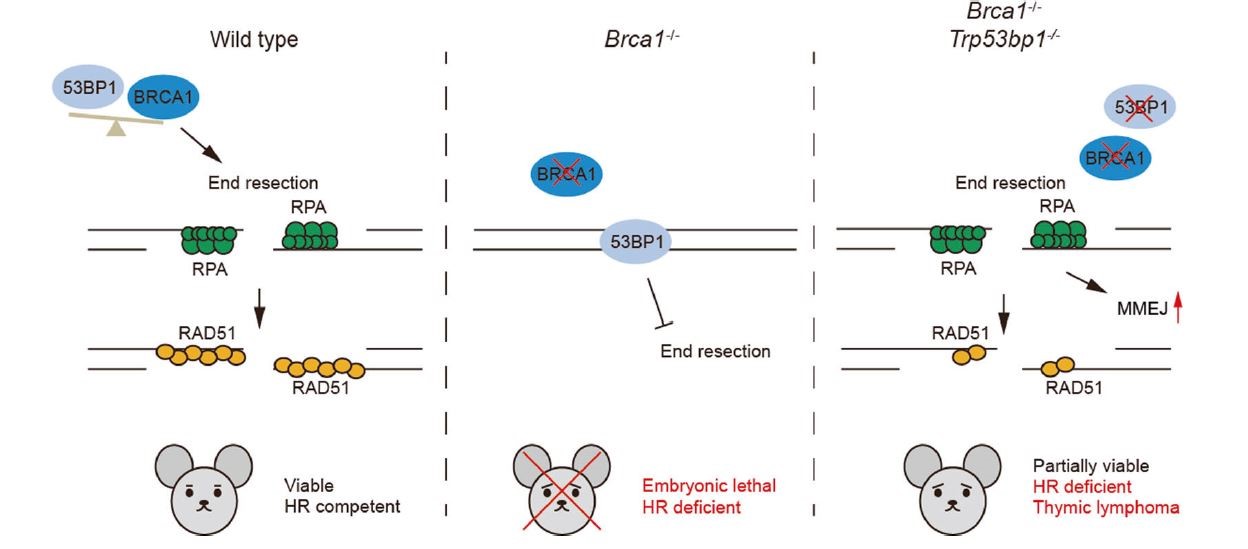
图1:53BP1敲除在同源重组修复缺陷依然存在的情况下部分拯救BRCA1完全缺失小鼠的胚胎发育障碍
陆林宇课题组的博士生陈绩源和李鹏为该论文的共同第一作者,硕士生宋立村和浙江大学医学院附属妇产科医院助理研究员白龙参与了部分工作。香港大学Michael S. Y. Huen教授为研究的顺利开展提供了重要帮助。陆林宇教授和课题组刘一丹副教授为该论文的共同通讯作者。该研究项目得到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金的资助。
论文链接:https://www.nature.com/articles/s41418-020-0521-4


