JEM丨吕志民团队合作研究揭秘胶质母细胞瘤免疫逃逸新机制
胶质母细胞瘤(glioblastoma multiforme,GBM)是一类常见的原发性恶性脑肿瘤。由于这类肿瘤恶性程度极高,所以绝大部分的患者预后极差:GBM患者经过手术放化疗等治疗手段后,其生存中位数仅为14个月左右,五年的生存率仍不到5%,因此GBM是当今肿瘤治疗中的重大挑战之一。随着肿瘤免疫治疗技术的进步与发展,给GBM的治疗带来了新的希望。
2020年8月27日,浙江大学转化医学研究院吕志民团队与温州医科大学检验医学院(生命科学学院)吕建新团队在Journal of Experimental Medicine杂志上在线发表了题为β-catenin induces transcriptional expression of PD-L1 to promote glioblastoma immune evasion的研究论文,该研究发现了GBM中激活异常的AKT/β-catenin信号会导致免疫检查点分子PD-L1表达水平升高并造成肿瘤免疫逃逸,基于该研究结果,研究人员使用AKT抑制剂MK2206与PD-1抗体联合用药治疗小鼠GBM模型,发现联合用药对GBM模型的治疗效果远好于单药治疗。
肿瘤细胞逃避免疫系统攻击的手段多样,其中较为常见的是产生一个不利于免疫细胞发挥杀伤作用的微环境和上调自身免疫抑制分子的表达水平等。PD-L1是由CD274编码的免疫抑制分子,它能通过与T细胞表面的PD-1结合,并导致T细胞的增殖、激活和杀伤能力等受到抑制。大量文献报道在肿瘤中PD-L1的表达水平显著高于癌旁组织,同时PD-L1水平越高也预示着更为糟糕的预后。吕志民与吕建新团队发现胶质瘤标本中激活的β-catenin水平与PD-L1表达水平呈正相关,而与肿瘤组织中浸润的CD8+T细胞数呈负相关;进一步研究发现Wnt通路和EGFR通路激活均可促使β-catenin激活,随后β-catenin与TCF/LEF形成复合物并结合到CD274基因的启动子上,从而引起PD-L1的表达水平升高;同时,研究人员还发现AKT介导了Wnt通路和EGFR通路对β-catenin/CD274的调控作用,故在后续的研究中,他们将PD-1抗体与已进入临床二期的AKT抑制剂MK2206联合用药治疗小鼠同种原位GBM模型,研究表明联合用药不但能更有效地促进肿瘤中CD8+T细胞的浸润水平,同时还能更显著地延长荷瘤小鼠的生存期。该研究揭示的分子机制简图如下所示:
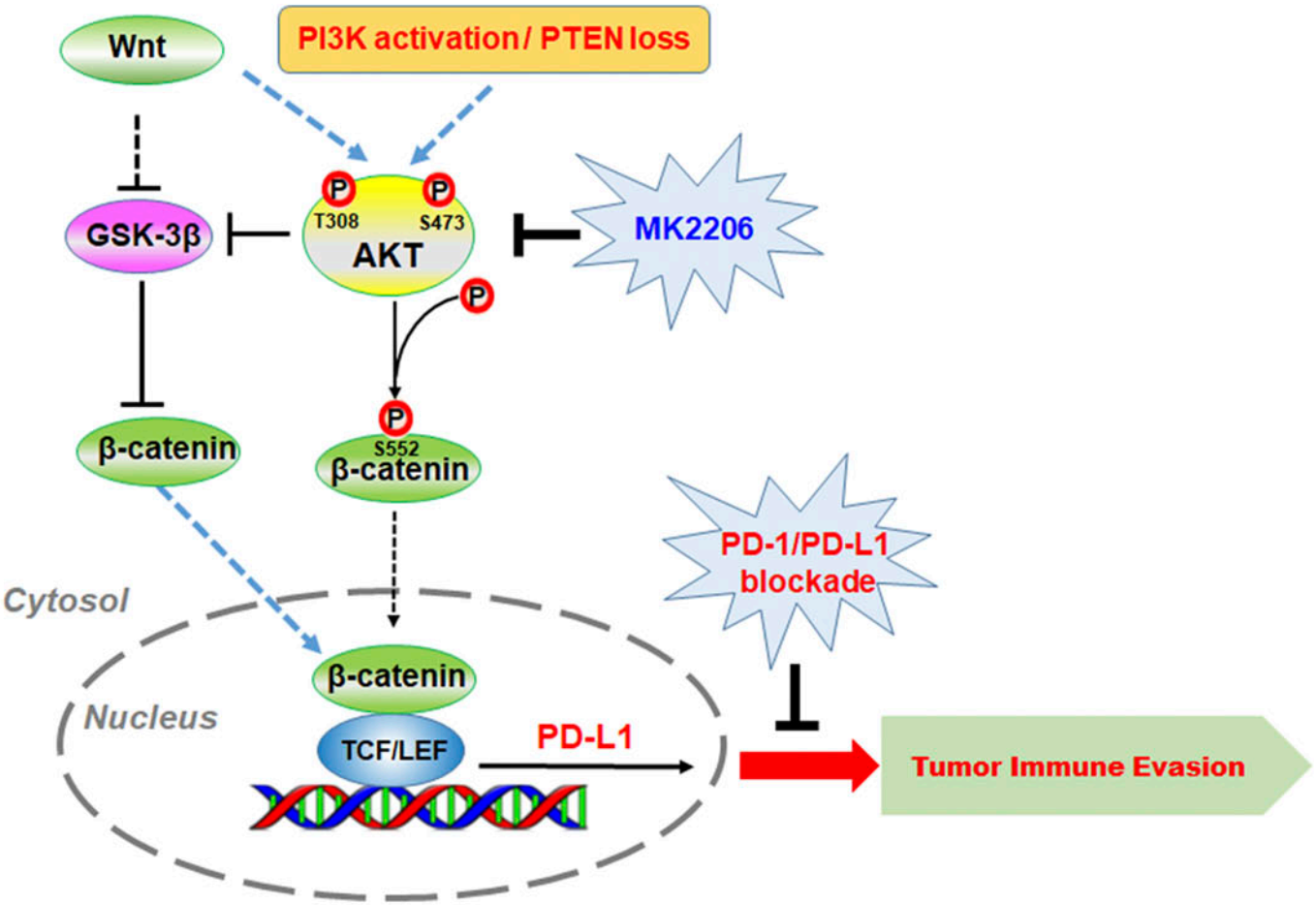
该研究率先揭示了肿瘤中AKT/β-catenin通路对免疫检查点PD-L1调控的机制,并提出了使用AKT抑制剂与PD-1抗体联合用药治疗胶质母细胞瘤的新策略,具有较高的临床转化价值。


