Immunity丨史鹏研究员团队发文揭示脑内免疫细胞的非免疫功能
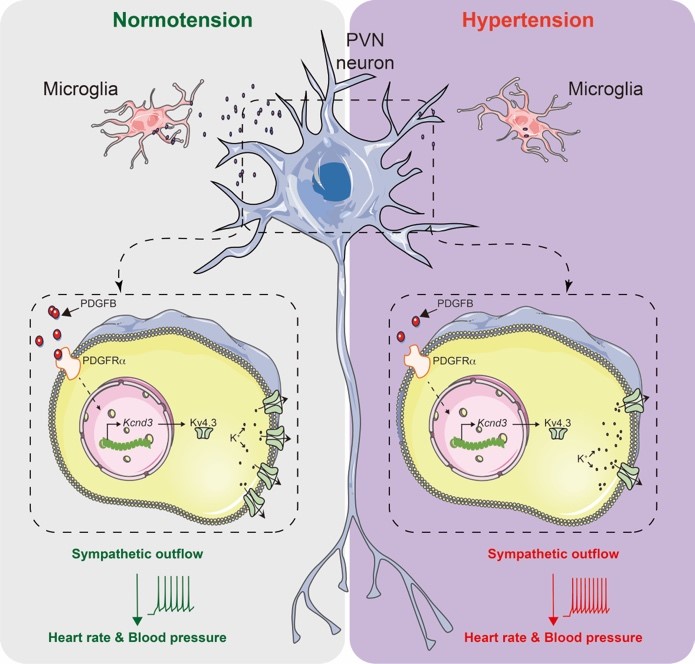
小胶质细胞调控中枢稳态的机制是近年来的研究热点,功能异常的小胶质细胞是导致神经退行性疾病的原因之一。作为脑内最主要的免疫细胞,小胶质细胞通过吞噬对神经元进行修饰,参与调控神经元新生、神经环路重塑、以及突触修剪。然而没有明确的证据表明小胶质细胞能够直接影响神经元的膜电兴奋性。2022年7月20日,来自浙江大学转化医学研究院/浙江大学医学院附属第二医院史鹏研究组、浙江大学基础医学院沈啸和谷岩研究团队合作在Immunity杂志上发表了题为“Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension”的文章,发现静息态下的小胶质细胞通过旁分泌PDGFB直接作用于下丘脑室旁核(PVN)前交感(pre-sympathetic)神经元上的PDGFR受体,促进该神经元中一种钾通道蛋白的表达,从而防止神经元超兴奋,维持正常的交感神经张力和血压。小鼠高血压模型下该通路被扰乱,造成持续性的交感高张,进一步加剧了高血压的进展。

心血管疾病是我国以及全球范围内排名第一的致死性和致残性疾病(Zhao et al., 2019)。然而,针对心血管疾病治疗的药物研发在过去的二十年中不足癌症药物开发的十分之一。举例而言,虽然在诸多心血管疾病的独立风险因素中高血压位列榜首(McClellan et al., 2019),但是最新获得FDA批准的降压药还停留在2007年诺华公司研发的Aliskiren(肾素抑制剂),距今15年该领域再无抗高血压新药问世。临床报道90%以上的高血压属于病因不明的原发性高血压,而大部分原发性高血压患者具有交感高张,且对部分难治型高血压患者实施肾交感消融术(Renal nerve denervation)可以有效缓解高血压症状(Azizi et al., 2021)。然而,中枢交感神经相关神经元的稳态如何被调控是长期以来领域里的难点。
该研究发现去除静息态的小胶质细胞会造成小鼠自主神经功能异常,表现为心率加快、心率变异度降低(heart rate variability)、以及减压反射敏感度(baroreflex sensitivity)和外周去甲肾上腺素升高,提示交感神经张力升高。通过膜片钳对下丘脑室旁核中投射到脑干头端腹侧延髓(RVLM)的前交感神经元(简称PVN-RVLM)进行电生理分析,发现去除了静息态的小胶质细胞极大的抑制了一过性外向钾电流(IA),导致PVN-RVLM神经元的电活性增加和交感输出增多。
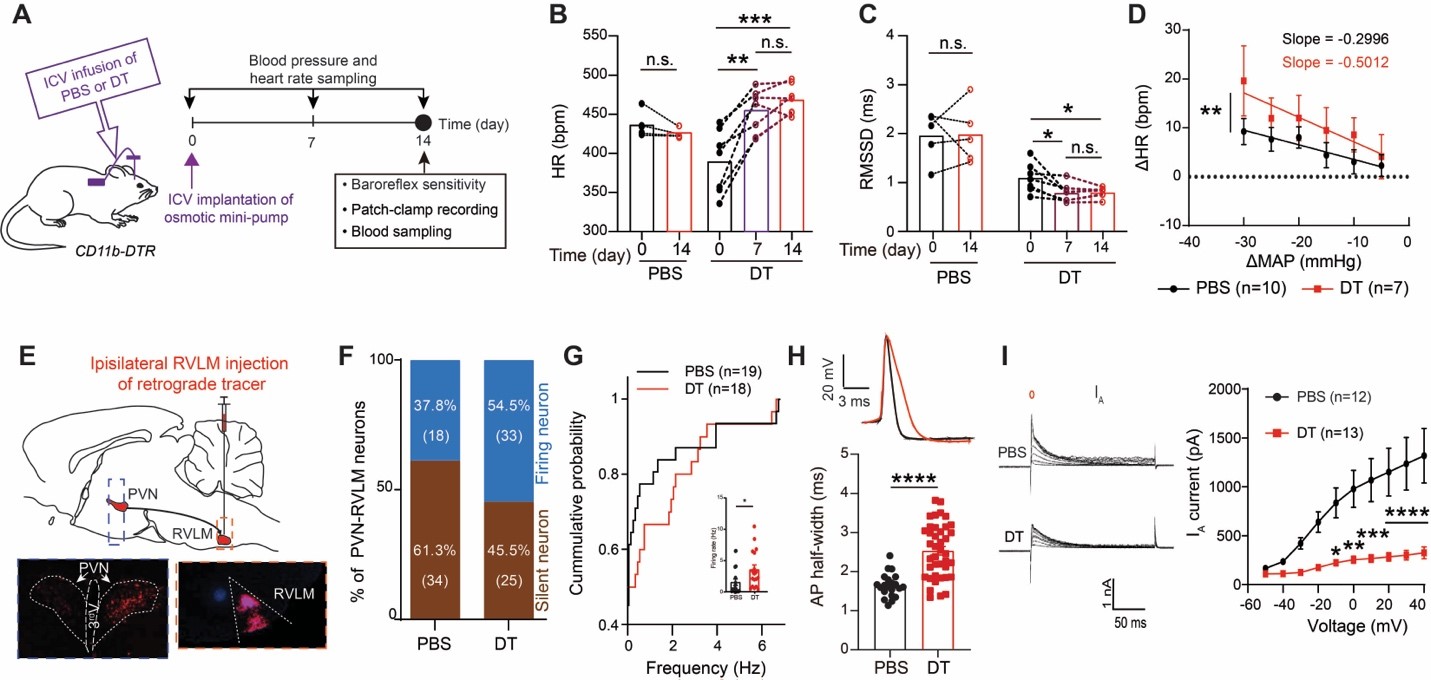
通过对PVN-RVLM神经元进行单细胞测序,发现小胶质细胞的缺失导致介导IA电流的钾离子通道编码亚基的Kcnd3表达减少。共培养实验表明小胶质细胞是通过旁分泌的形式对神经元中该基因进行直接调控。为了解析小胶质细胞通过何种介质维持神经元中Kcnd3的表达,作者重点分析了成年小鼠静息态小胶质细胞转录本中高表达的分泌型蛋白,发现血小板生长因子B(Pdgfb)在小胶质细胞中表达显著高于脑内其他类型细胞(包括脑内的边界巨噬细胞)。特异性去除小胶质细胞中的Pdgfb可以再现去除小胶质细胞后的自主神经功能紊乱以及电生理特性。相反,在小胶质细胞缺失的小鼠中外源性补给重组PDGFB蛋白有效的缓解了上述表型,提示小胶质细胞中的PDGFB是维持神经元中Kv4.3 (Kcnd3基因编码蛋白)表达的必要因素。而这一作用是否是PDGFB对神经元的直接影响呢?接下来,作者通过特异性敲降PVN-RVLM神经元中的PDGFR(而非PDGFR),证明了这一小胶质细胞→神经元的直接旁分泌作用。
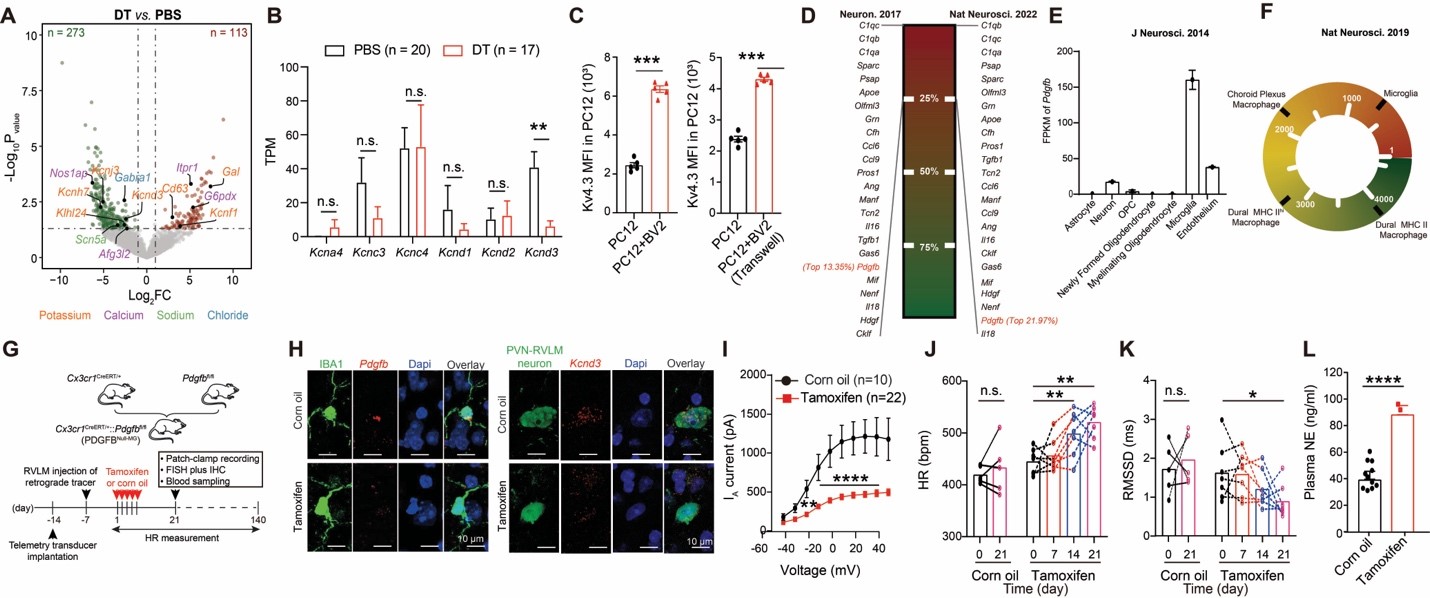
接下来,研究者进一步探究是否小胶质细胞对神经元的调控异常是导致高血压下交感神经亢奋的原因。研究者发现多种高血压小鼠模型中小胶质细胞的PDGFB表达以及PVN-RVLM神经元中的Kv4.3表达均显著下调。去除小胶质细胞中的Pdgfb或者外源性补给重组PDGFB蛋白均可以改变高血压的进程。提示这一通路的受损参与了交感高张和血压的升高。PDGFR受体属于酪氨酸激酶(Tyrosine kinase receptor)家族成员,其抑制剂是临床中广泛使用的抗肿瘤药物之一,通过抑制血管新生达到抗肿瘤的效果。临床报告该类激酶抑制剂(tyrosine kinase inhibitor [TKI])的使用会造成高血压这一不良反应(Azizi et al., 2008; Escalante and Zalpour, 2011)。Immunity报道的这项研究发现,正常小鼠给予TKI类药物pazopanib后会出现PVN-RVLM神经元钾电流降低、交感高张、高血压的表型,与临床报道极为相似。通过在PVN-RVLM神经元中过表达Kv4.3能起到拮抗pazopanib诱导的升压效果,明确了TKI类药物导致血压升高这一不良反应的细胞分子机制。
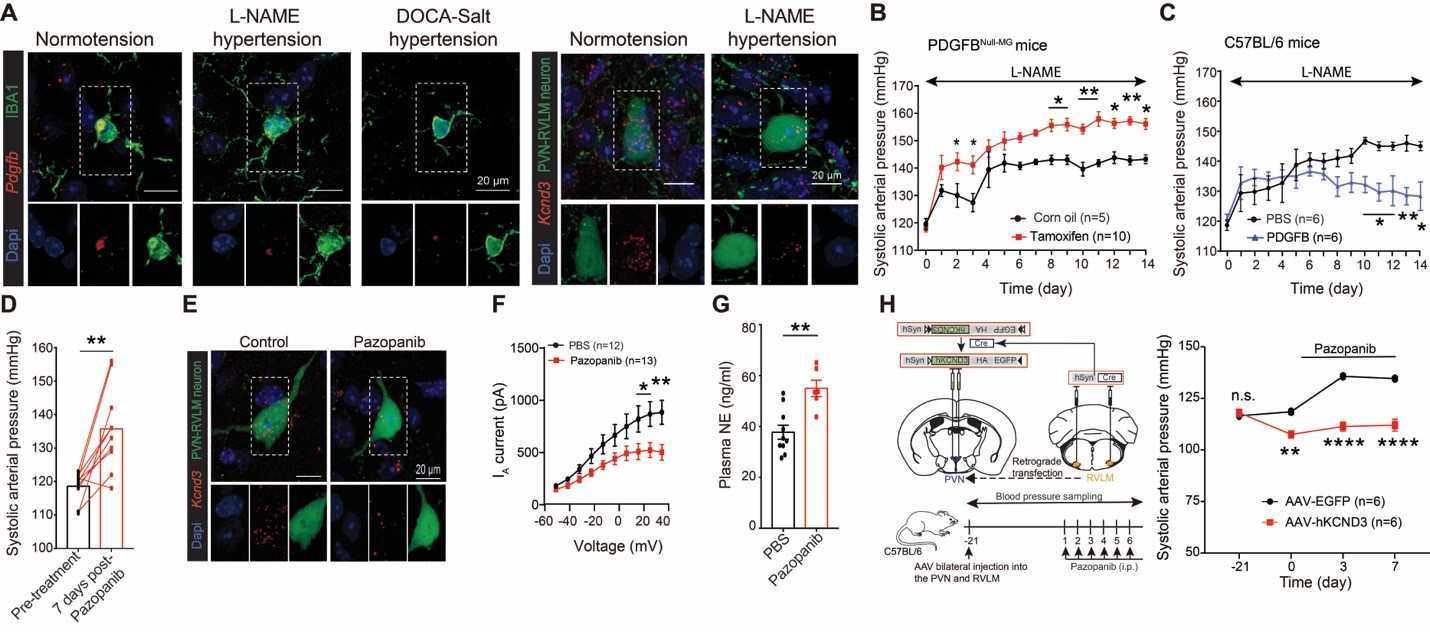
综上所述,这项工作首次揭示了静息态的小胶质细胞通过不断旁分泌PDGFB控制神经元超兴奋这一全新的中枢稳态调控机制,从而达到维持正常的交感神经活性以及心血管功能稳态,丰富了对脑内两种细胞间交互作用的认识。
本课题得到国家自然基金委面上项目以及浙江省基金委重点项目的资助。同时对推进本课题进展的浙江大学医学院附属浙江医院脑科中心刘小利、万曙、李力主任医师,浙江大学医学院汪仪研究员,浙江大学生物医学工程与仪器科学学院赵立研究员,以及西安交通大学医学部徐佳曦研究员表示诚挚的谢意!
史鹏研究员课题组长期致力于脑内自主神经参与心血管以及神经退行性疾病的机制研究,在Circulation Research, Hypertension, Stroke,Pharmacological Research,Science Immunology等一系列心血管以及免疫专业期刊发表学术论文三十多篇。通过综合应用心血管以及神经电生理功能分析,系统解析正常以及病理进程中对下丘脑室旁核(PVN)前交感神经元活性的调控机制,揭示作为维持神经内分泌稳态的关键中枢核团,PVN如何参与外周心血管功能以及免疫调控。在此诚挚邀请对该方向感兴趣研究生以及博士后加盟。
文章链接:https://doi.org/10.1016/j.immuni.2022.06.018
参考文献:
1.Azizi, M., Chedid, A., and Oudard, S. (2008). Home blood-pressure monitoring in patients receiving sunitinib. N Engl J Med 358, 95-97.
2. Azizi, M., Sanghvi, K., Saxena, M., Gosse, P., Reilly, J.P., Levy, T., Rump, L.C., Persu, A., Basile, J., Bloch, M.J., et al. (2021). Ultrasound renal denervation for hypertension resistant to a triple medication pill (RADIANCE-HTN TRIO): a randomised, multicentre, single-blind, sham-controlled trial. Lancet 397, 2476-2486.
3. Escalante, C.P., and Zalpour, A. (2011). Vascular endothelial growth factor inhibitor-induced hypertension: basics for primary care providers. Cardiol Res Pract 2011, 816897.
4. McClellan, M., Brown, N., Califf, R.M., and Warner, J.J. (2019). Call to Action: Urgent Challenges in Cardiovascular Disease: A Presidential Advisory From the American Heart Association. Circulation 139, e44-e54.
5. Zhao, D., Liu, J., Wang, M., Zhang, X., and Zhou, M. (2019). Epidemiology of cardiovascular disease in China: current features and implications. Nat Rev Cardiol 16, 203-212.


