Advanced Science丨闵军霞与王福俤团队合作揭示转铁蛋白受体调控脂肪细胞产热及细胞命运的新机制
4月24,来自浙江大学医学院/转化医学研究院闵军霞团队、王福俤团队,以及广东省微生物研究所谢黎炜团队在国际著名学术期刊Advanced Science(影响因子15.804)发表题为“Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes”的研究论文[1]。揭示转铁蛋白受体(Transferrin Receptor 1, Tfr1)通过特异机制调控棕色/米色脂肪细胞功能和发育。在米色脂肪形成过程中,活化的缺氧诱导因子HIF1α通过转录调控Tfr1表达促进铁吸收从而维持线粒体功能;在棕色脂肪发育过程中,Tfr1以非铁依赖的方式调控棕色脂肪与白色脂肪、肌细胞的转分化。

脂肪组织是参与调控全身能量代谢的重要器官,主要由三种脂肪细胞构成:白色、棕色和米色。白色脂肪用于贮存能量,而棕色脂肪用于消耗能量,通过非战栗性产热来维持体温恒定。活化棕色脂肪有助于机体抵抗能量摄入过多引起的脂肪堆积,从而抑制肥胖的发生[2]。米色脂肪是近年来新发现可以被冷刺激或β3-肾上腺素受体激动剂诱导形成的一种产热脂肪,在治疗肥胖及相关代谢性疾病方面有极好的应用前景[3]。通过深入了解白色脂肪米色样变及棕色脂肪形成和活化的分子调控机制,对于靶向干预促进棕色/米色脂肪产热具有重要的理论和实践意义。
微量元素铁在维持营养和能量代谢平衡中扮演重要角色[4]。脂肪细胞铁稳态代谢的研究多集中在白色脂肪。在白色脂肪细胞分化过程中,通过DFO螯合细胞中铁离子或者敲降转铁蛋白(Tf)可以显著抑制脂合成[5];添加铁和Tf可以促进脂肪细胞脂解[6],抑制胰岛素刺激的葡萄糖吸收[7]。遗传性低铁模型Tmprss6敲除小鼠脂肪组织铁含量减少,白色脂肪脂解增加,从而抵抗高脂膳食诱导的肥胖[8]。然而铁稳态代谢对棕色脂肪细胞分化产热以及白色脂肪米色化的调控作用及其分子机制尚待深入研究。
研究人员在β3肾上腺素激动剂CL-316,243诱导米色脂肪形成的小鼠模型上,通过H3K9/14Ac ChIP-seq、RNA-seq和iTRAQ膜蛋白质组等多种组学技术发现铁稳态代谢被明显富集,并筛选出转铁蛋白受体Tfr1表达显著上调。随后发现Tfr1脂肪特异性敲除(Tfr1Adp/Adp)小鼠对冷不耐受,冷诱导的米色脂肪细胞形成被抑制,冷诱导的棕色脂肪产热和脂解减少,线粒体形态和铁稳态代谢异常(图一)。在高脂膳食(HFD)诱导的肥胖模型下,Tfr1敲除虽然不影响食欲和体重,但是可加剧HFD诱导的脂代谢紊乱、胰岛素抵抗和脂肪组织炎症。

图一:Tfr1脂肪特异性敲除小鼠棕色/米色脂肪功能异常
(选自Li et al. Advanced Scicence, 2020)
随后,研究人员对米色脂肪形成过程中Tfr1表达上调的分子机制进行了研究,发现缺氧诱导因子HIF1α蛋白表达和入核活化明显增加,棕色脂肪特异性敲除Hif1α (Hif1Ucp1/Ucp1)小鼠表现出冷诱导的米色脂肪生成被抑制,而棕色脂肪却未见明显改变。通过Chip-qPCR实验发现冷刺激可以诱导米色脂肪HIF1α与Tfr1 启动子结合促进其转录。以上结果提示冷刺激诱导HIF1α活化,通过转录调控Tfr1表达控制铁吸收从而促进白色脂肪米色化。
为了解析Tfr1敲除导致棕色脂肪功能异常的机制,研究人员通过转录组分析发现Tfr1敲除可以明显增加干细胞、白色脂肪细胞和肌细胞标志基因表达,并对这些基因表达进行验证。从而表明Tfr1在棕色脂肪细胞命运决定中扮演重要角色。然而这一作用与Tfr1敲除造成的低铁状态无关,因为无论是遗传性低铁(Tmprss6-/-)小鼠模型还是孕期低铁饲喂均不能模拟Tfr1敲除引起的棕色脂肪细胞向肌细胞转分化,表明Tfr1可能通过非铁依赖的作用调控棕色脂肪细胞分化。然而Tmprss6-/-小鼠冷诱导的米色脂肪生成被抑制,表明铁稳态在白色脂肪米色化过程中起重要作用。Tfr1如何通过铁依赖与非铁依赖作用调控棕色/米色脂肪细胞产热和分化仍待进一步研究。
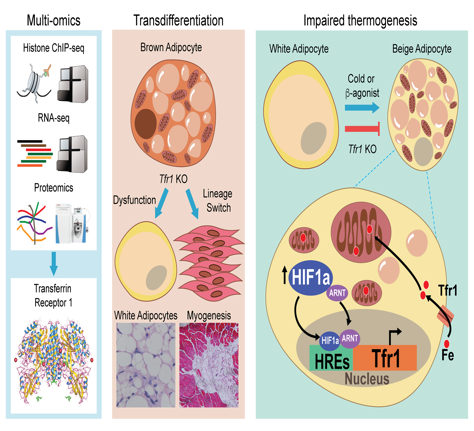
图二:Tfr1调控棕色/米色脂肪细胞产热和分化的模式图
(选自Li et al. Advanced Scicence, 2020)
总之,该成果发现Tfr1和铁稳态代谢在调控棕色和米色脂肪细胞产热和命运决定中的关键作用,并从机制上揭示了冷刺激诱导活化的HIF1α通过转录调控Tfr1促进白色脂肪米色化,这一重大发现将为脂肪细胞生理和机体铁稳态代谢提供新的认识,为肥胖及相关代谢性疾病机制探索和靶向治疗提供新的方向和思路。
浙江大学转化医学院李瑾博士后(闵军霞教授团队)和广东省微生物研究所的潘潇寒研究助理为本文的并列第一作者;闵军霞教授、王福俤教授及广东省微生物研究所谢黎炜研究员为共同通讯作者;浙江大学医学院/转化医学研究院/第一附属医院为第一作者及通讯作者单位。
该项目得到国家自然科学基金委及国家科技部项目资助。
参考文献:
1.Li J#, Pan X#, Pan G, Song Z, He Y, Zhang S, Ye X, Yang X, Xie E, Wang X, Mai X, Yin X, Tang B, Shu X, Chen P, Dai X, Tian Y, Yao L, Han M, Xue G, Zhong H, Sun J, Chen H, Wang F*, Min J*, Xie L*. Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes. Advanced Science 2020.
全文链接: https://doi.org/10.1002/advs.201903366
2.Lowell BB, V SS, Hamann A, Lawitts JA, Himms-Hagen J, Boyer BB, Kozak LP, Flier JS. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue. Nature 1993, 366(6457): 740-742.
3.Wu J, Bostrom P, Sparks LM, Ye L, Choi JH, Giang AH, Khandekar M, Virtanen KA, Nuutila P, Schaart G, Huang K, Tu H, van Marken Lichtenbelt WD, Hoeks J, Enerback S, Schrauwen P, Spiegelman BM. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell 2012, 150(2): 366-376.
4.王佳明, 安鹏, 王浩, 吴谦, 方学贤, 闵军霞, 王福俤. 铁稳态代谢分子机制及铁磁纳米颗粒研究进展. 科学通报, 2018, 63, Doi:10.1360/N972018-00707
5.Moreno-Navarrete JM, Ortega F, Moreno M, Ricart W, Fernandez-Real JM. Fine-tuned iron availability is essential to achieve optimal adipocyte differentiation and mitochondrial biogenesis. Diabetologia 2014, 57(9): 1957-1967.
6.Rumberger JM, Peters T, Jr., Burrington C, Green A. Transferrin and iron contribute to the lipolytic effect of serum in isolated adipocytes. Diabetes 2004, 53(10): 2535-2541.
7.Green A, Basile R, Rumberger JM. Transferrin and iron induce insulin resistance of glucose transport in adipocytes. Metabolism: clinical and experimental 2006, 55(8): 1042-1045.
8.Folgueras AR, Freitas-Rodriguez S, Ramsay AJ, Garabaya C, Rodriguez F, Velasco G, Lopez-Otin C. Matriptase-2 deficiency protects from obesity by modulating iron homeostasis. Nature communications 2018, 9(1): 1350.
点评专家:
刘平生(中科院生物物理所特聘研究员,中国生物物理学会总干事长,以脂滴研究为基础,长期从事脂质储存和代谢与相关疾病研究)
肥胖症已成为全球最大的慢性疾病,严重威胁人类健康。然而通过饮食和行为干预很难实现对肥胖相关代谢性疾病的长期改善作用。目前有一种切实可行的方式,就是通过药物干预增加脂肪酸和葡萄糖氧化。近年来研究发现的多种因子如β3-肾上腺素激动剂、FGF21、SLIT2和犬尿酸等可以促进全身能量消耗,增进胰岛素敏感性,从而抑制肥胖[1-4]。而这些因子的主要作用机制是活化棕色脂肪产热和促进白色脂肪米色化,因而阐明决定棕色脂肪产热和白色脂肪米色化的关键调控过程,有利于我们寻找治疗肥胖等代谢性疾病的候选药物。
本文作者向我们展示了铁代谢在棕色和米色脂肪产热和分化中所扮演的重要角色。文章中指出Tfr1作为细胞吸收铁的重要受体,是肩胛骨棕色脂肪组织(iBAT)消耗脂肪酸并转化为热量所必需的。此外Tfr1还参与了腹股沟皮下白色脂肪(iWAT)向米色脂肪分化及产热。此外,文章中还利用遗传性低铁小鼠模型,发现脂肪组织铁含量降低时产热也减少,进一步表明铁稳态代谢在脂肪组织产热中的关键作用。尽管有研究报道体内铁稳态代谢失衡对脂肪组织产热产生影响[5],然而这篇文章表明了,脂肪组织铁稳态代谢的调控是以细胞自发性的行为来控制产热。因此,该研究极大地丰富了我们对于脂肪组织生理的认识,明确了细胞铁稳态代谢是调控产热脂肪组织功能和转分化的关键因素,表明脂肪组织Tfr1是治疗肥胖等代谢性疾病的潜在靶点。
肩胛骨棕色脂肪细胞与骨骼肌细胞同源,均是由Myf5+/Pax7+的前体细胞发育而来。目前已经报道的可以调控棕色脂肪与肌细胞转分化,大多是转录因子、microRNA和甲基化修饰酶,如Ebf2、Prdm16、ZFP516、EHMT1、microRNA-133和Mettl3等[6-10]。该研究发现Tfr1敲除后棕色脂肪细胞去分化,并向白色和肌肉细胞转分化,表明Tfr1是控制棕色脂肪细胞命运决定的关键膜蛋白。然而这一过程不依赖于铁稳态代谢,展现了Tfr1除经典的铁吸收作用以外的非铁依赖作用。有研究表明,Tfr1通过与Hfe结合调控Hepcidin表达[11];在小肠上皮细胞上特异性敲除Tfr1导致小鼠肠上皮细胞发育和功能异常,过表达Tfr1R654A突变体可以部分恢复肠上皮细胞功能,表明Tfr1通过非铁依赖作用调控小肠上皮细胞功能[12]。因此,进一步深入研究Tfr1的信号转导作用,将有利于深化我们对棕色脂肪细胞命运决定的认识。
1.Fisher FM, Kleiner S, Douris N, Fox EC, Mepani RJ, Verdeguer F, Wu J, Kharitonenkov A, Flier JS, Maratos-Flier E, Spiegelman BM. FGF21 regulates PGC-1alpha and browning of white adipose tissues in adaptive thermogenesis. Genes & development 2012, 26(3): 271-281.
2.Agudelo LZ, Ferreira DMS, Cervenka I, Bryzgalova G, Dadvar S, Jannig PR, Pettersson-Klein AT, Lakshmikanth T, Sustarsic EG, Porsmyr-Palmertz M, Correia JC, Izadi M, Martinez-Redondo V, Ueland PM, Midttun O, Gerhart-Hines Z, Brodin P, Pereira T, Berggren PO, Ruas JL. Kynurenic Acid and Gpr35 Regulate Adipose Tissue Energy Homeostasis and Inflammation. Cell metabolism 2018, 27(2): 378-392 e375.
3.Svensson KJ, Long JZ, Jedrychowski MP, Cohen P, Lo JC, Serag S, Kir S, Shinoda K, Tartaglia JA, Rao RR, Chedotal A, Kajimura S, Gygi SP, Spiegelman BM. A Secreted Slit2 Fragment Regulates Adipose Tissue Thermogenesis and Metabolic Function. Cell metabolism 2016, 23(3): 454-466.
4.Liu X, Perusse F, Bukowiecki LJ. Mechanisms of the antidiabetic effects of the beta 3-adrenergic agonist CL-316243 in obese Zucker-ZDF rats. The American journal of physiology 1998, 274(5): R1212-1219.
5.Blankenhaus B, Braza F, Martins R, Bastos-Amador P, Gonzalez-Garcia I, Carlos AR, Mahu I, Faisca P, Nunes JM, Ventura P, Hoerr V, Weis S, Guerra J, Cardoso S, Domingos A, Lopez M, Soares MP. Ferritin regulates organismal energy balance and thermogenesis. Molecular metabolism 2019, 24: 64-79.
6.Seale P, Bjork B, Yang W, Kajimura S, Chin S, Kuang S, Scime A, Devarakonda S, Conroe HM, Erdjument-Bromage H, Tempst P, Rudnicki MA, Beier DR, Spiegelman BM. PRDM16 controls a brown fat/skeletal muscle switch. Nature 2008, 454(7207): 961-967.
7.Ohno H, Shinoda K, Ohyama K, Sharp LZ, Kajimura S. EHMT1 controls brown adipose cell fate and thermogenesis through the PRDM16 complex. Nature 2013, 504(7478): 163-167.
8.Dempersmier J, Sambeat A, Gulyaeva O, Paul SM, Hudak CS, Raposo HF, Kwan HY, Kang C, Wong RH, Sul HS. Cold-inducible Zfp516 activates UCP1 transcription to promote browning of white fat and development of brown fat. Molecular cell 2015, 57(2): 235-246.
9.Yin H, Pasut A, Soleimani VD, Bentzinger CF, Antoun G, Thorn S, Seale P, Fernando P, van Ijcken W, Grosveld F, Dekemp RA, Boushel R, Harper ME, Rudnicki MA. MicroRNA-133 controls brown adipose determination in skeletal muscle satellite cells by targeting Prdm16. Cell metabolism 2013, 17(2): 210-224.
10.Wang Y, Gao M, Zhu F, Li X, Yang Y, Yan Q, Jia L, Xie L, Chen Z. METTL3 is essential for postnatal development of brown adipose tissue and energy expenditure in mice. Nature communications 2020, 11(1): 1648.
11.Schmidt PJ, Toran PT, Giannetti AM, Bjorkman PJ, Andrews NC. The transferrin receptor modulates Hfe-dependent regulation of hepcidin expression. Cell metabolism 2008, 7(3): 205-214.
12.Chen AC, Donovan A, Ned-Sykes R, Andrews NC. Noncanonical role of transferrin receptor 1 is essential for intestinal homeostasis. Proceedings of the National Academy of Sciences of the United States of America 2015, 112(37): 11714-11719.
Hao Zhu, Ph.D.
Associate Professor
Clinical Laboratory Sciences
University of Kansas Medical Center, U.S.A.
Dysregulation of cellular iron metabolism leads to development of many diseases, including Type 2 diabetes and obesity. Transferrin receptor 1 (Tfr1) imports transferrin-bound iron to maintain iron homeostasis in a wide range of cells and tissues, however, the functional role of Tfr1 in adipose tissues was mostly unclear. In a recent collaborative study led by Professors Fudi Wang and Junxia Min at Zhejiang University and Dr. Liwei Xie at Guangdong Institute of Microbiology, Tfr1 is reported for the first time to regulate thermogenic capacity and cell fate determination in beige and brown adipocytes. Combining transcriptomic, proteomic, molecular and cellular approaches with mouse models of tissue-specific gene ablation, the authors demonstrated that Tfr1 is essential for beige adipocyte formation and thermogenesis and that Tfr1 deficiency in brown preadipocytes leads to its trans-differentiation into muscle-like cells. The functional impact of Tfr1 in beige fat appears to be mediated by hypoxia inducible factor 1a-dependent transcriptional activation of Tfr1, and Tfr1 deficiency leads to iron deficiency, mitochondrial dysfunction, impaired lipolysis, as well as cold intolerance and increased susceptibility to metabolic defects under a high-fat diet. This study offers new insights into why and how iron and mitochondrial function are required to activate lipolytic properties during brown adipocyte differentiation as previously observed by others. The current findings can also guide our efforts to target the development of beige adipocyte with metallic therapeutics as a potential treatment of obesity and metabolic diseases.
孟卓贤(浙江大学医学院研究员,优青,长期从事胰岛、骨骼肌和脂肪代谢相关研究)
脂肪是体内重要的代谢和内分泌器官。哺乳动物体内的脂肪组织按功能可分为三大类:以储存能量为主的白色脂肪,以产热消耗能量为主的棕色脂肪,和介于二者之间、功能可塑的米色脂肪。棕色和米色脂肪都具有产热功能,所以统称为“产热脂肪”。白色脂肪主要以大脂滴、高甘油三酯为主要特征,相反,产热脂肪则以含有大量腔房小脂滴及丰富线粒体为特征。因为激活产热脂肪能够增加机体能量消耗,有望治疗肥胖及其相关代谢性疾病,近年来一直是代谢研究领域关注的热点。迄今为止,产热脂肪,尤其是米色脂肪,发育分化和精准调控的分子机制还有待于进一步阐明。
由浙江大学医学院王福俤教授、闵军霞教授和广东省微生物研究所、华南应用微生物国家重点实验室的谢黎炜研究员作为共同通讯作者合作发表于《先进科学》杂志(Advanced Science)的论文:“Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes”,揭示转铁蛋白受体(Tfr1)在棕色/米色脂肪产热以及细胞命运决定方面的重要作用。作者首先利用多组学技术发现Tfr1介导的铁离子转运和吸收参与冷刺激或者β3肾上腺素受体激动剂CL-316,243诱导的米色脂肪细胞代谢产热,提示Tfr1及其介导的铁离子转运可能在产热脂肪的功能调控中发挥重要作用。为了证明这一点,申请人构建了脂肪细胞特异性Tfr1 敲除小鼠,发现Tfr1缺失显著抑制了小鼠棕色脂肪和米色脂肪的产热功能,更容易发生高脂饮食诱导的胰岛素抵抗和糖尿病。进一步研究发现,冷刺激或者β3肾上腺素受体激动剂CL-316,243处理显著上调米色脂肪组织中缺氧诱导因子HIF1α(Hypoxia inducible factors 1α)的mRNA和蛋白的表达。近年来许多研究提示,在生理和病理状态下,组织缺氧可通过缺氧诱导因子HIFs介导的信号通路调控组织稳态和代谢平衡。缺氧诱导因子由α和β亚基组成,其中α亚基包括HIF1α, HIF2α和HIF3α,可能参与不同组织稳态和代谢平衡的调控[1],但是HIFs在产热脂肪功能调控中的作用尚不清楚。本研究首次证实 HIF1α 而非HIF2α蛋白表达在冷刺激后显著上调,且在米色脂肪细胞核内显著富集。接着,作者利用Ucp1-Cre 的工具鼠构建了Ucp1+脂肪细胞特异性Hif1α基因敲除小鼠,结果发现Hif1α基因敲除仅抑制冷刺激诱导的米色脂肪的代谢和产热功能而对棕色脂肪细胞的产热功能无明显影响。进一步机制研究发现HIF1α能够与Tfr1启动子上缺氧反应元件直接结合并上调其基因转录。总的来说,这是一项非常有意义的工作,从如下两个新角度阐释了产热脂肪代谢功能的调控机制:一是本研究发现微量元素铁离子代谢稳态在脂肪组织的代谢和产热功能调控中发挥重要调控作用;二是揭示HIF1α及其下游缺氧信号在米色脂肪细胞的代谢和产热功能调节中的重要作用。本研究中也发现一些很有意思的现象,还有待于进一步深入探究,如Tfr1可能通过铁离子非依赖机制影响产热脂肪的发育和代谢功能,另外,Tfr1的表达在棕色脂肪细胞是如何被调控的。这些问题解决将有助于进一步阐明产热脂肪的发育和代谢的调控机制,为针对产热脂肪的肥胖相关代谢病的治疗提供理论基础。
[1] Gonzalez, F.J., C. Xie, and C. Jiang, The role of hypoxia-inducible factors in metabolic diseases. Nat Rev Endocrinol, 2018. 15(1): p. 21-32.


