Nature Cell Biology丨吕志民/李新建团队运用CRISPR基因编辑抑制肿瘤生长
CRISPR和以此延伸发展的程序性碱基编辑(programmable base editing,PBE)技术可对真核细胞基因组进行改造,有巨大的临床应用价值,然而,这些技术是否也能应用在肿瘤的治疗上还尚少有研究。在许多人类肿瘤中,存在端粒酶基因(TERT)的启动子区域的突变。例如,在目前缺乏有效治疗手段的恶性胶质瘤中,有高达83%患者的肿瘤组织中存在着端粒酶基因启动子区域的致癌突变,该突变会激活端粒酶基因表达,驱动肿瘤恶性进展。因此,精准修正端粒酶基因启动子区域的致癌突变将会是一种具有开创性的肿瘤治疗方法。
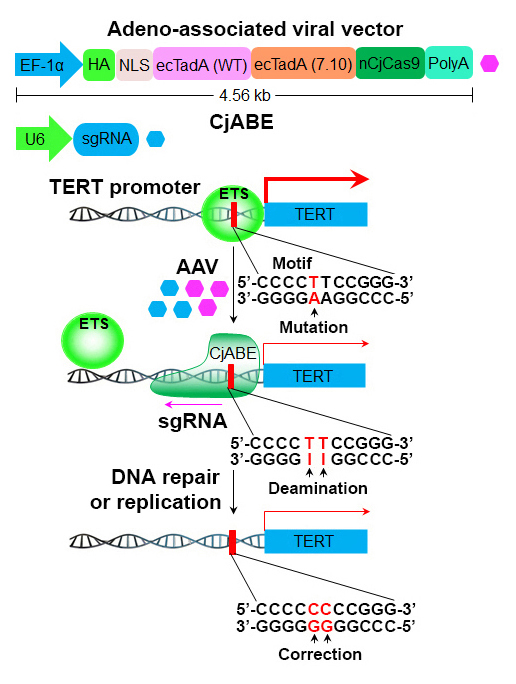
2020年2月17日,浙江大学转化医学研究院吕志民团队联合中国科学院生物物理研究所李新建团队在Nature Cell Biology杂志上在线发表了题为Programmable base editing of mutated TERT promoter inhibits brain tumour growth的研究论文,该研究使用腺相关病毒(Adeno-associated virus, AAV)作为载体表达拥有腺嘌呤脱氨酶活性的空肠弯曲菌(Campylobacter jejuni)Cas9融合蛋白以及对应的单向导RNA(sgRNA),实现精准修正恶性胶质瘤细胞端粒酶基因启动子区域的致癌突变,以抑制肿瘤细胞生长。

端粒(Telomere)位于真核细胞染色体末端,由碱基重复序列和结合蛋白组成,已知的端粒的功能是防止染色体DNA降解、末端融合。正常细胞线性DNA复制时5'末端消失,随着细胞不断增殖,端粒逐渐缩短,当端粒缩至一定程度,染色体变得不稳定,导致细胞发生衰老和凋亡。端粒酶(Telomerase)是端粒DNA的逆转录酶,以RNA为模板、端粒3'末端为引物,合成端粒重复序列,维持染色体端粒DNA的长度。人体正常细胞中端粒酶的活性较低,随着细胞分裂端粒不断缩短,最后导致细胞停止分裂或凋亡。恶性肿瘤细胞为了满足无限增殖的需要,通过端粒酶基因启动子区域突变和端粒替代加长(Alternative lengthening of telomeres, ALT)两种机制维持染色体端粒的长度,避免细胞衰老。
CRISPR-Cas9系统由原核细胞获得性免疫系统改造而来,可用于编辑真核细胞的基因组DNA序列。依据宿主来源的不同,Cas9蛋白可分为Streptococcus pyogenes Cas9 (SpCas9)、Staphylococcus aureus Cas9 (SaCas9)、Campylobacter jejuni Cas9 (CjCas9) 等不同的种类。为了避免修复Cas9介导的DNA双链断裂时造成的碱基错配,研究人员开发出一套依赖于腺嘌呤脱氨酶和SpCas9切口酶活性的碱基编辑系统【1】。吕志民、李新建团队在此基础上用基因编码序列较短的CjCas9切口酶替换原来的SpCas9切口酶,以便使用包装容量有限的腺相关病毒载体表达腺嘌呤脱氨酶和CjCas9切口酶的融合蛋白,并把该融合蛋白命名为空肠弯曲菌腺嘌呤碱基编辑器(Campylobacter jejuni adenine base editor, CjABE)。腺相关病毒表达载体具有免疫原性低、宿主细胞类型广谱、表达时间持久等优点。该研究使用腺相关病毒作为碱基编辑器CjABE的表达载体,精准修正胶质瘤细胞端粒酶基因启动子区域的致癌突变,从而减少肿瘤细胞中TERT基因的转录和蛋白表达,抑制其分裂, 诱导恶性胶质瘤细胞的衰老及凋亡。原位注射表达CjABE的腺相关病毒能够有效抑制小鼠移植瘤的生长并延长荷瘤小鼠的生存时间。
该研究开创性地利用基因编辑以修正癌变基因,为癌症治疗提供了崭新的思路和方法,并揭示了端粒酶基因启动子区域突变是肿瘤精准治疗的靶点。
南京医科大学公共卫生学院钱旭教授为本文的共同第一作者。
原文链接:
https://doi.org/10.1038/s41556-020-0471-6
参考文献
1. Gaudelli, N. M. et al. Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage. Nature 551, 464–471 (2017).


