STTT丨闵军霞教授团队合作研究发现金化合物引发铁死亡新机制
近日,浙江大学转化医学研究院闵军霞教授团队联合王福俤及梁廷波教授团队在铁死亡研究领域获得重大突破;新成果发表在Nature出版集团旗下权威学术期刊《Signal Transduction and Targeted Therapy》(影响因子13.493)。
论文题目:Auranofin(金诺芬) Mitigates Systemic Iron Overload and Induces Ferroptosis via Distinct Mechanisms。(1)
论文免费下载链接:https://rdcu.be/b5Zqi
图1 Online发表论文首页
通过筛选“640种美国食品和药物管理局(FDA)批准的临床小分子药物库”,研究人员发现类风湿性关节炎的治疗药物金诺芬(Auranofin,或简称金)能够显著激活铁调素(Hepcidin)从而有效减轻铁过载负担;并阐明其通过激活NF-κB/IL-6/JAK-STAT信号通路上调Hepcidin而降低铁过载的分子调控机制。简而言之,金可降铁。
令人惊奇的是高剂量金诺芬可以引发铁死亡。通过抑制硫氧还蛋白还原酶TXNRD活性导致脂质过氧化及铁死亡(Ferroptosis)发生(小鼠致死),提示TXNRD是铁死亡的关键调节因子;铁死亡抑制剂Ferrostatin-1(Fer-1)可显著保护高剂量金诺芬引发的肝脏损伤等致死毒副作用。即,过多的金,虽能降铁,但会引发由铁离子参与的细胞死亡——铁死亡。
该研究成果提示金诺芬不仅能够作为治疗遗传性血色病及Hepcidin缺乏引发的铁过载相关疾病的潜在新药物,而且为靶向铁死亡减轻金诺芬的副作用及建立铁死亡新型体内动物实验模型提供了重要理论依据。
该成果的4点重要创新发现:
(1)金诺芬(金化合物)有望成为男性血色病及铁过载疾病的新型治疗药物
(2)揭示铁死亡是大剂量金诺芬的毒副作用的分子机制
(3)金诺芬联合铁死亡抑制剂可极大拓展其临床应用
(4)建立全球首个药物(金诺芬)诱导肝脏铁死亡的小鼠模型
金诺芬(Auranofin)是由Smith Kline & French研制的一类专为治疗类风湿性关节炎的口服小分子含金化合物(图2)。金诺芬微溶于水,易溶于类脂体。在1985年被FDA批准用于治疗类风湿性关节炎(2)。近年实验研究提示金诺芬对肝癌、霍奇金氏淋巴瘤、头颈部肿瘤等多种疾病显示出良好的治疗效果(3-5)。
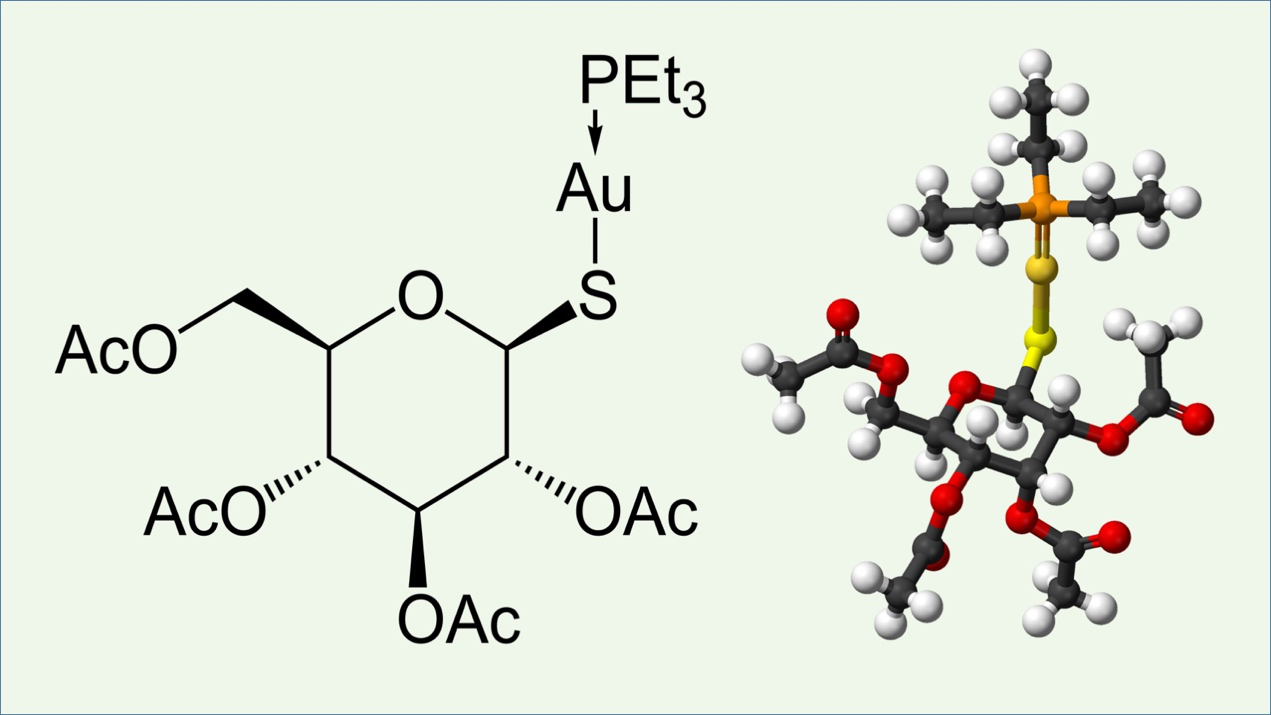
图2 金诺芬的分子式
铁稳态代谢在维持机体正常生理功能中具有极其重要的作用。Hepcidin作为铁代谢关键调节因子,其表达异常会导致铁代谢紊乱,引发多种疾病。阐明Hepcidin分子调控机制,有望为铁代谢疾病的防治提供新策略,因此业已成为目前营养学与医学的重要科学问题。近年,针对Hepcidin的小分子化合物的筛选与研发是铁代谢领域的研究热点,有报道提示可上调或者抑制Hepcidin的单体或者复合物,然而,这些化合物的功能尚待进一步临床试验验证。
为了寻找老药新用,在王福俤和闵军霞教授指导下,研究人员利用人源细胞体系功能筛选了640种FDA批准的临床药物,发现治疗类风湿关节炎的药物金诺芬能够显著上调Hepcidin的基因表达,且与浓度和作用时间呈现较好的量效关系;进一步体内外实验揭示了金诺芬通过激活NF-κB/IL-6/JAK-STAT信号通路上调Hepcidin表达的分子机制。
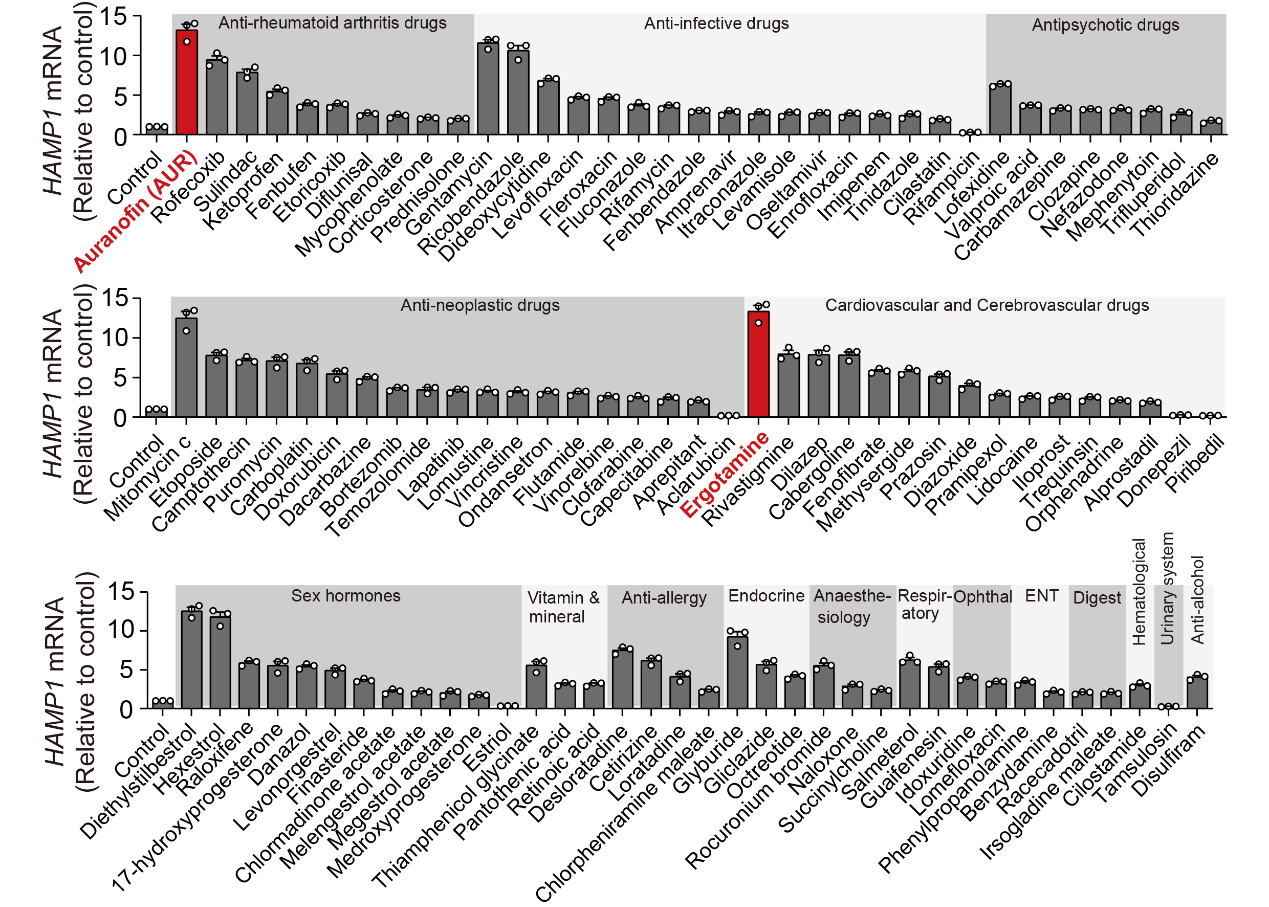
图3 小分子药物初筛发现金诺芬显著上调Hepcidin
(选自论文,Figure 1)
金诺芬能否改善遗传性血色病的铁过载?利用经典Hfe-/-血色病铁过载模型,研究人员发现低剂量金诺芬(5mg/kg体重)长期给药能够有效升高雄性小鼠肝脏Hepcidin表达、降低机体铁过载负担,而对雌性小鼠则无明显降铁效果。
男性血色病的发病率远远高于女性(男8/女1),为了进一步深入探索雌雄性别药效差异的原因,研究人员发现雌二醇显著抑制金诺芬诱导的IL-6/STAT3/Hepcidin信号轴,提示雌激素可能是金诺芬降铁效应呈现性别差异的原因。这些结果表明金诺芬通过上调Hepcidin减轻铁过载,有望成为男性遗传性血色病的治疗新策略。

图4 金诺芬上调Hfe-/-雄鼠体内Hepcidin表达及减轻铁过载
(选自论文, Figure 5)
有趣的是,虽然高剂量金诺芬(25mg/kg)的降铁效果比低剂量更明显,然而,意外的发现是高剂量金诺芬用药30天会导致小鼠死亡。
在探究高剂量金诺芬致死机制的过程中,研究人员惊喜地发现,给予铁死亡抑制剂Fer-1不仅能够显著改善肝脏损伤和铁死亡生化指标,而且完全挽救高剂量金诺芬引发的小鼠死亡;机制研究发现金诺芬通过抑制硫氧还蛋白还原酶TXNRD,导致细胞膜脂质过氧化累积,最终引发铁死亡。这些结果表明金诺芬是一种全新的铁死亡激动剂;铁死亡抑制剂Fer-1与金诺芬联用可有效降低金诺芬的药物毒性。
铁死亡是肝损伤、心肌损伤等重大疾病的共性病理机制,探究铁死亡分子机制,研发铁死亡激动剂和抑制剂将为相关疾病治疗提供新思路及新策略。目前,铁死亡小鼠模型多集中在Gpx4等基因敲除小鼠和缺血/再灌注等病理损伤模型,该成果首次建立药物诱导的铁死亡小鼠模型——高剂量金诺芬肝损伤模型,将拓展铁死亡研究领域。
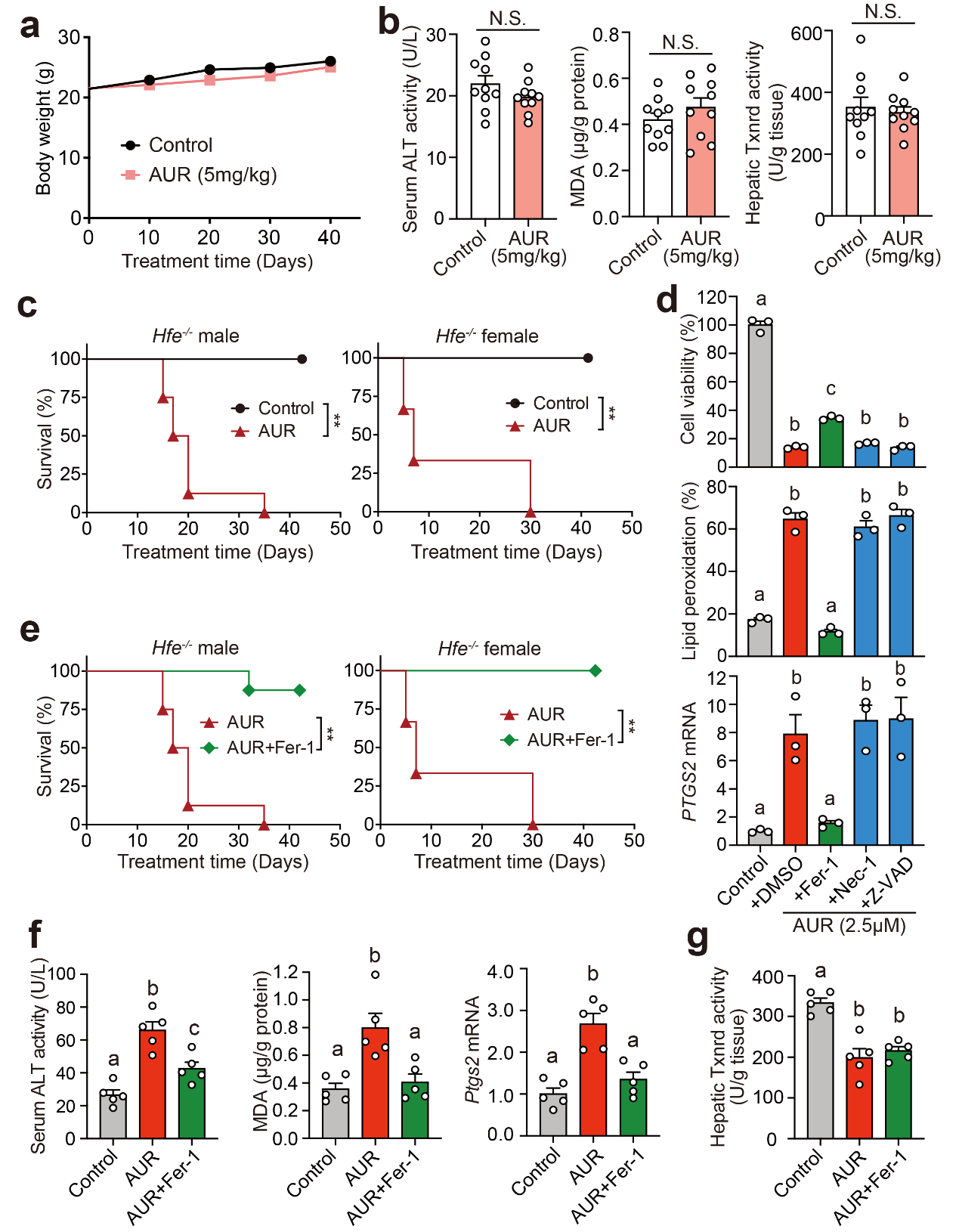
图5 高剂量金诺芬引发体内铁死亡
(选自论文, Figure 6)
总之,该研究的主要科学贡献为:
(1)首次发现金诺芬通过激活Hepcidin可治疗铁过载相关疾病,如遗传性血色病。
(2)揭示大剂量金诺芬引发铁死亡的功能和机制并成功构建金诺芬诱导的铁死亡小鼠模型。
(3)发现铁死亡抑制剂Fer-1能够有效防治高剂量金诺芬引发的毒性反应,同时并不影响其降铁功效。总之,该成果不仅丰富了肝脏Hepcidin调控和铁死亡发生的分子机制,同时为铁过载疾病防治提供了新策略。

图6 金诺芬调控Hepcidin和铁死亡模式图
(选自论文, Figure S6)
浙江大学医学院/转化医学研究院博士研究生杨翔为共同第一作者;共同第一作者还有郑州大学公共卫生学院博士研究生杨磊及王浩副教授。
浙江大学医学院王福俤教授、闵军霞教授和梁廷波教授(浙江大学医学院第一附属医院)为论文共同通讯作者。
该研究成果得到国家重点研发计划和国家自然科学基金经费资助。

图7 论文第一作者及通讯作者
(从左至右:王浩、王福俤、闵军霞、杨磊、杨翔)
铁代谢与铁死亡是王福俤和闵军霞教授团队重点攻关的研究方向。通过多年不懈努力,团队取得系列相关研究成果(图8)。在铁代谢方向,团队目前已报道了能够靶向Hepcidin,改善贫血和铁过载的多种小分子化合物,如鸡血藤、黑豆皮提取物、杨梅素、维生素B4、恩替诺特(Entinostat)等(6)。在肝脏铁死亡方向,团队2017年在《Hepatology》杂志发表封面论文,首次将铁代谢异常与铁死亡联系起来,发现铁死亡是铁过载导致肝脏病理损伤的重要机制并首次揭示了转运蛋白SLC7A11体内参与调控肝脏细胞铁死亡的过程(7);今年5月发表的《Blood》论文系统揭示并阐明肝脏转铁蛋白Transferrin和金属离子转运通道Slc39a14(Zip14)调控铁代谢和铁死亡的分子机制,为防治肝损伤、肝纤维化及肝硬化等疾病提供了新靶点和新思路(8)。在心脏铁死亡方向,团队在《PNAS》刊文首次揭示了阿霉素引发心肌病与心肌缺血再灌注损伤的两种重要体内模型中存在铁死亡及其重要意义,并阐明线粒体膜的脂质过氧化是心肌细胞发生铁死亡的关键机制(9);今年5月发表的《Circulation Research》论文阐明了铁蛋白(Ferritin)通过调控铁死亡抑制心肌病发生的效应及分子调控机制,首次体内揭示Slc7a11能够通过阻断心肌细胞发生铁死亡而有效逆转铁蛋白缺失导致的心肌病,有望成为心脏疾病防治新靶点(10)。此外,团队在铁死亡领域应邀发表多篇综述。在《Nutrients》发表综述系统总结了铁代谢与铁死亡的调控关联(11)。在《科学通报》发表题为“铁过载及铁死亡在心脏疾病中的研究进展”的封面评述,化用上古神话“女娲补天”形象展示靶向铁死亡防控心脏疾病的转化研究及潜在临床应用的积极前景(12)。

图8 团队围绕“调控Hepcidin功能分子与铁死亡”取得系列成果
参考文献
1. Lei Yang#, Hao Wang#, Xiang Yang#, Qian Wu, Peng An, Xi Jin, Weiwei Liu, Xin Huang, Yuzhu Li,Shiyu Yan, Shuying Shen, Tingbo Liang*, Junxia Min*, Fudi Wang*. Auranofin mitigates systemic iron overload and induces ferroptosis via distinct mechanisms. Signal Transduction and Targeted Therapy 2020; .5, 138 (2020). https://doi.org/10.1038/s41392-020-00253-0
2. Tepperman K, Finer R, Donovan S, Elder RC, Doi J, Ratliff D, Ng K. Intestinal uptake and metabolism of auranofin, a new oral gold-based antiarthritis drug. Science 1984;225:430-432.
3. M. Celegato, C. Borghese, N. Casagrande, M. Mongiat, X. U. Kahle, A. Paulitti, M. Spina, A. Colombatti, and D. Aldinucci. Preclinical activity of the repurposed drug auranofin in classical Hodgkin lymphoma. Blood 2015;126:1394-1397.
4. D. Lee, I. M. Xu, D. K. Chiu, J. Leibold, A. P. Tse, M. H. Bao, V. W. Yuen, C. Y. Chan, R. K. Lai, D. W. Chin, D. F. Chan, T. T. Cheung, S. H. Chok, C. M. Wong, S. W. Lowe, I. O. Ng, and C. C. Wong. Induction of Oxidative Stress Through Inhibition of Thioredoxin Reductase 1 Is an Effective Therapeutic Approach for Hepatocellular Carcinoma. Hepatology 2019;69:1768-1786.
5. W. C. Stafford, X. Peng, M. H. Olofsson, X. Zhang, D. K. Luci, L. Lu, Q. Cheng, L. Tresaugues, T. S. Dexheimer, N. P. Coussens, M. Augsten, H. M. Ahlzen, O. Orwar, A. Ostman, S. Stone-Elander, D. J. Maloney, A. Jadhav, A. Simeonov, S. Linder, and E. S. J. Arner. Irreversible inhibition of cytosolic thioredoxin reductase 1 as a mechanistic basis for anticancer therapy. Sci Transl Med 2018;10.
6. 王佳明, 安鹏, 王浩, 吴谦, 方学贤, 闵军霞, 王福俤. 铁稳态代谢分子机制及铁磁纳米颗粒研究进展. 科学通报 2019;64:788-801.
7. H. Wang, P. An, E. Xie, Q. Wu, X. Fang, H. Gao, Z. Zhang, Y. Li, X. Wang, J. Zhang, G. Li, L. Yang, W. Liu, J. Min, and F. Wang. Characterization of ferroptosis in murine models of hemochromatosis. Hepatology 2017;66:449-465.
8. Y. Yu, L. Jiang, H. Wang, Z. Shen, Q. Cheng, P. Zhang, J. Wang, Q. Wu, X. Fang, L. Duan, S. Wang, K. Wang, P. An, T. Shao, R. T. Chung, S. Zheng, J. Min, and F. Wang. Hepatic Transferrin Plays a Role in Systemic Iron Homeostasis and Liver Ferroptosis. Blood 2020.
9. X. Fang, H. Wang, D. Han, E. Xie, X. Yang, J. Wei, S. Gu, F. Gao, N. Zhu, X. Yin, Q. Cheng, P. Zhang, W. Dai, J. Chen, F. Yang, H. T. Yang, A. Linkermann, W. Gu, J. Min, and F. Wang. Ferroptosis as a target for protection against cardiomyopathy. Proc Natl Acad Sci U S A 2019;116:2672-2680.
10. X. Fang, Z. Cai, H. Wang, D. Han, Q. Cheng, P. Zhang, F. Gao, Y. Yu, Z. Song, Q. Wu, P. An, S. Huang, J. Pan, H. Z. Chen, J. Chen, A. Linkermann, J. Min, and F. Wang. Loss of Cardiac Ferritin H Facilitates Cardiomyopathy via Slc7a11-Mediated Ferroptosis. Circ Res 2020.
11. Imam MU, Zhang S, Ma J, Wang H, Wang F. Antioxidants Mediate Both Iron Homeostasis and Oxidative Stress. Nutrients 2017;9.
12. 方学贤, 蔡昭贤, 王浩, 闵军霞, 王福俤. 铁过载及铁死亡在心脏疾病中的研究进展. 科学通报 2019;64:2974-2987.


