孙毅团队揭示E3连接酶FBXW7的抑癌新机制
FBXW7是一种抑制肿瘤生长的SCF E3泛素连接酶。在大多数情况下,FBXW7识别磷酸化底物并促进它的泛素化降解[1]。目前报道,FBXW7主要通过泛素化降解几个关键促癌蛋白,包括c-Myc、MCL-1、c-Jun、Notch1和cyclin E而发挥抑癌功能。SHOC2充当RAS和RAF的支架在秀丽隐杆线虫(c.elegans)中被首次报道,并激活RAS/ERK通路[2]。在大多数癌症中,SHOC2的表达上调[3]。在哺乳动物细胞中,mTOR存在于两种多蛋白复合物中:Mlst8、Raptor、Deptor和Pras40形成mTORC1;Mlst8、Msin1、Rictor、Deptor和Protor-1/2形成mTORC2。mTORC1主要通过磷酸化S6K1和4E-BP1来调节蛋白质翻译、细胞大小和细胞增殖,而mTORC2通过直接磷酸化和激活AKT和SGK1来调节细胞存活[4]。此外,mTORC是一种成熟的自噬的负调节因子[5],涉及许多生理和病理过程[6]。尽管FBXW7是一个典型的抑癌蛋白,而RAS/ERK和mTORC1信号通路是两条重要的致癌和促癌通路,它们三者之间是否存在相互调控尚不清楚。
最近,美国密西根大学和浙江大学转化医学研究院的孙毅教授课题组在Cell Reports发表了题为The FBXW7-SHOC2-Raptor axis controls the cross-talks between the RAS/ERK and mTORC1 signaling pathways的文章,报道了FBXW7通过泛素化降解SHOC2来调控RAS/ERK与mTORC1两种信号途径,从而调节肿瘤细胞的生长和自噬的发生。
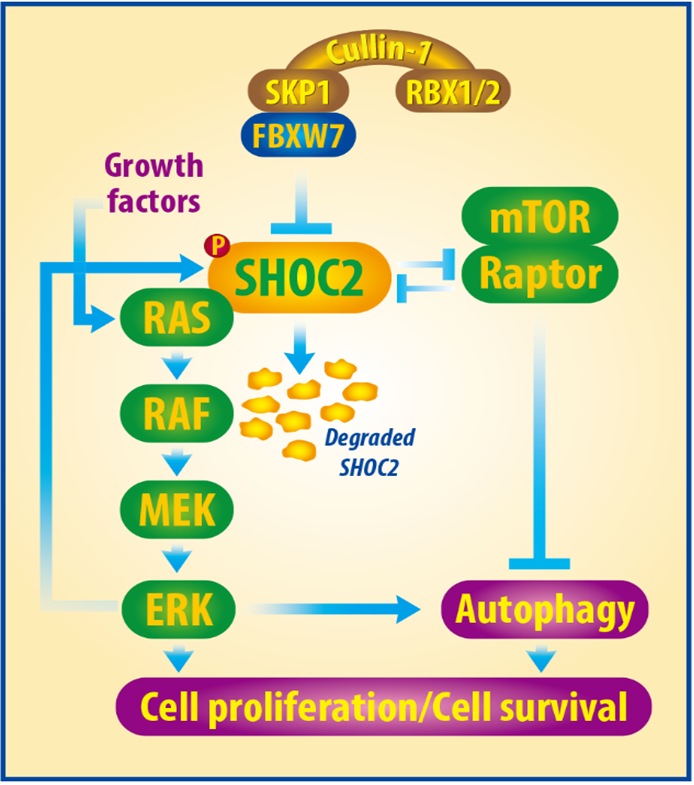
该研究团队发现SHOC2是FBXW7的一个新底物,生长因子激活MAPK信号,触发SHOC2上的 Thr507磷酸化,从而促进SHOC2与FBXW7结合,导致SHOC2的泛素化降解,终止RAS-MAPK信号并抑制增殖; 更有趣的是,SHOC2能选择性地与Raptor结合,从而竞争性地抑制Raptor-mTOR结合,使mTORC1失活并诱导自噬,而Raptor与SHOC2结合竞争性地抑制SHOC2-Ras结合,从而阻断MAPK通路和细胞增殖(如下图)。最后,该团队发现SHOC2在胰腺癌中过度表达,且与患者生存率呈显著负相关,并在肺癌中发现了多个功能活化的SHOC2突变。总之,该研究第一次建立了1)生长因子激活MAPK信号通路,导致SHOC2的磷酸化和泛素化降解,从而灭活MAPK信号通路的负反馈调节; 2)SHOC2-Raptor相互作用可触发RAS/ERK和mTORC1通路之间的交叉负调控反应,而两者之间的相互负调控可被肿瘤抑制蛋白FBXW7通过靶向SHOC2 的降解所调节。由此,FBXW7-SHOC2-RAPTOR信号轴精准调控细胞增殖和自噬发生。
参考文献:
1.Welcker, M., and Clurman, B.E. (2008). FBW7 ubiquitin ligase: a tumour suppressor at the crossroads of cell division, growth and differentiation. Nat Rev Cancer 8, 83-93.
2.Selfors, L.M., Schutzman, J.L., Borland, C.Z., and Stern, M.J. (1998). soc-2 encodes a leucine-rich repeat protein implicated in fibroblast growth factor receptor signaling. Proc Natl Acad Sci U S A 95, 6903-6908.
3.Young, L.C., Hartig, N., Munoz-Alegre, M., Oses-Prieto, J.A., Durdu, S., Bender, S., Vijayakumar, V., Vietri Rudan, M., Gewinner, C., Henderson, S., et al. (2013). An MRAS, SHOC2, and SCRIB complex coordinates ERK pathway activation with polarity and tumorigenic growth. Mol Cell 52, 679-692.
4.Guertin, D.A., and Sabatini, D.M. (2007). Defining the role of mTOR in cancer. Cancer Cell 12, 9-22.
5.Jung, C.H., Ro, S.H., Cao, J., Otto, N.M., and Kim, D.H. (2010). mTOR regulation of autophagy. FEBS Lett 584, 1287-1295.
6.Mizushima, N., Yoshimori, T., and Levine, B. (2010). Methods in mammalian autophagy research. Cell 140, 313-326.


