靶向拟素化修饰调控线粒体能量代谢,抑制肿瘤细胞生长
代谢是机体生命活动的基本特征,代谢的调控决定着细胞生长、分裂和死亡。能量是生命机体生长和繁殖的驱动力,主要通过氧化磷酸化和糖酵解途径产生。细胞能量代谢在一定条件下能进行重编程,以适应外界环境。近年来,细胞能量代谢异常作为肿瘤的特征之一,已受到紧密关注,成为当前肿瘤研究最前沿的领域之一。因此,对肿瘤代谢异常及其调控机制的研究,能为解析肿瘤的发生和发展提供全新的突破口,并为肿瘤的靶向治疗提供新的策略和手段。
Neddylation(拟素化)信号通路参与的蛋白翻译后修饰,仅调节蛋白活性或功能但不介导其被26S蛋白酶体降解。拟素化过程与泛素化过程类似,通过NEDD8激活酶 E1(NEDD8-activating enzyme, NAE)、NEDD8耦联酶 E2(NEDD8-conjugating enzyme)和E3 连接酶(E3 ligase)组成的三联酶促反应将泛素样小分子NEDD8 与目标蛋白共价结合,进而调控包括肿瘤发生发展在内的多种生物学过程。在被NEDD8修饰的底物中,目前以Cullin-RING ligase(CRL)E3 泛素连接酶形式存在的 Cullin 家族蛋白研究最多。小分子化合物MLN4924是新近研发的、目前唯一一个拟素化信号通路的抑制剂,已被广泛应用于拟素化信号通路生化功能及其在生物学过程的相关研究中。目前,拟素化信号通路是否及如何调控细胞代谢是领域内一个重要而未明确的问题。
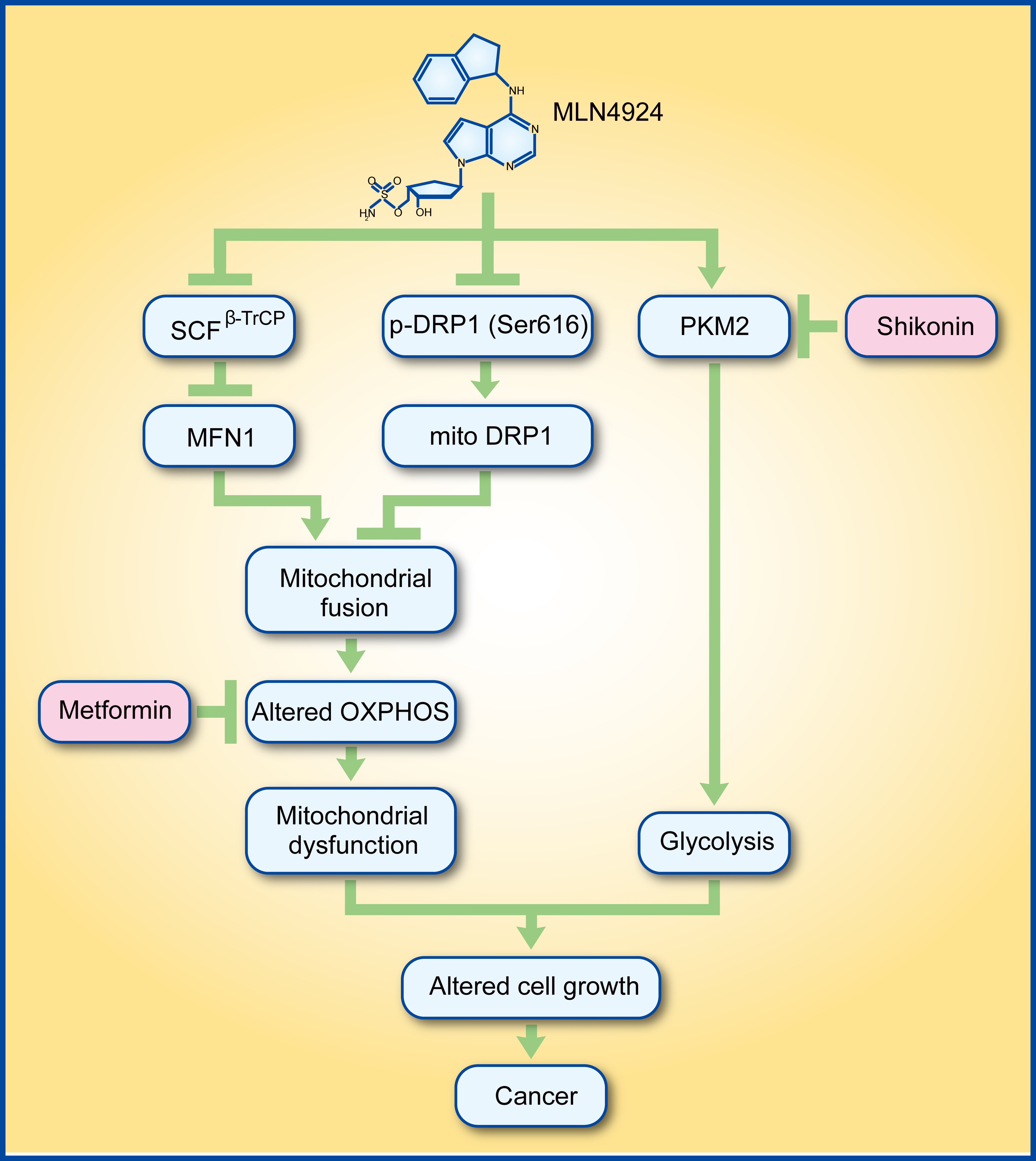
2019年2月21日,国际学术期刊JCI Insight 发表了孙毅课题组研究成果“Inhibiting neddylation modification alters mitochondrial morphology and reprograms energy metabolism in cancer cells”。该研究主要发现,1) 抑制拟素化通路促进细胞氧化磷酸化和糖酵解进而介导细胞代谢变化,但线粒体功能降低;2) 靶向氧化磷酸化或糖酵解能增敏MLN4924的肿瘤杀伤作用。
鉴于线粒体作为细胞内参与细胞代谢的一个重要细胞器,研究者首先使用MLN4924或基因敲减NAE催化亚基UBA3抑制拟素化通路,通过免疫荧光和透射电镜明确拟素化通路抑制诱导线粒体动力学从分裂向融合转换。机制研究发现MLN4924抑制拟素化通路后,线粒体融合蛋白MFN1表达显著增加,而线粒体分裂调控因子DRP1表达没有改变。
由于DRP1通过在细胞质与线粒体的穿梭调控线粒体动力学变化,随后研究发现细胞质DRP1含量在MLN4924处理后显著增加而其在线粒体含量显著减少,DRP1在线粒体中含量的减少是由于其616位点磷酸化水平减弱。为了进一步明确MFN1在拟素化通路抑制后调控的线粒体动力学变化,研究发现MFN1敲降可完全抑制MLN4924诱导的线粒体融合。进一步探究MLN4924诱导的MFN1表达增高的原因,发现MFN1序列含有经典保守的SCFβ-TrCP E3泛素连接酶的结合位点,在明确线粒体中也含SCFβ-TrCP E3泛素连接酶组分后,研究者使用一系列生化手段鉴定了CRL/SCFβ-TrCP E3泛素连接酶对MFN1的泛素化降解作用。同时,F-box β-TrCP调控线粒体动力学从分裂向融合的转换。因此,该结果证实MFN1可被CRL E3泛素连接酶调控,同时,MFN1成为SCFβ-TrCP E3泛素连接酶的新底物。
既然拟素化通路抑制调控线粒体动力学,那么线粒体功能及细胞代谢有何变化?研究者使用非靶向代谢组学分析发现,拟素化通路抑制后细胞线粒体功能减弱,糖酵解增加。随后,研究者检测了一系列线粒体功能,发现尽管其功能减弱,但氧气消耗增加。由于拟素化通路抑制促进细胞糖酵解,研究者发现MLN4924促进了糖酵解关键代谢酶PKM2活性的增加。PKM2活性增加是由于MLN4924促进了其活性形式的四聚体形成,而非其蛋白表达。这是关于MLN4924活性的一个全新发现,与它的拟素化抑制无关。
线粒体融合诱导的细胞氧化磷酸化增加和糖酵解分别有报道指出其对肿瘤细胞存活有保护作用。MLN4924由于在临床前研究中展示了很好的肿瘤杀伤作用,目前已进入临床Ⅱ期研究。为了进一步揭示靶向拟素化通路和细胞能量代谢对肿瘤细胞生长的影响,研究者使用MLN492联合氧化磷酸化抑制剂metformin或PKM2抑制剂shikonin,体外细胞实验及体内肿瘤模型实验结果均指出同时靶向拟素化通路和细胞能量代谢可显著抑制肿瘤细胞增殖。研究结果为MLN4924联合用药提出了可行的方案。
该研究主要由孙毅实验室的周启银博士完成,多名浙江大学和密西根大学的研究人员参与了该项工作。


