Matter评述丨王本:不分血型通用红细胞的化学制备展望
近日,浙江大学转化医学研究院/浙江大学医学院附属第二医院王本教授团队受邀在Matter期刊上发表了题为“Artificially engineered red blood cells for universal blood transfusion”的评述文章,介绍了一项由华南理工大学的朱伟教授团队发表于PNAS(Proceedings of the National Academy of Sciences of the United States of America)的突破性研究。该研究通过硅化技术对红细胞进行表面修饰改造,为红细胞披上“纳米硅甲”,使其能够打破血型匹配限制,实现“通用型输血”。评述对这项技术的潜在应用场景、临床转化挑战及未来发展方向进行了深入分析和前瞻性展望。
红细胞是哺乳动物血液中数量最多的一种血细胞,也是体内气体交换和能量传递的重要媒介。依据表面是否存在由糖蛋白及糖链构成的抗原决定簇特征,红细胞可分为不同的血型。在临床红细胞输注应用中,供血者与受血者的血型不匹配输注会引发溶血性输血反应,严重者会造成受血者休克甚至死亡。当前,特殊患者的血型鉴定困难或者交叉配血不合依然是输血医学中最核心的问题,尤其是针对稀有血型人群的应急输血面临着极大的需求难题。
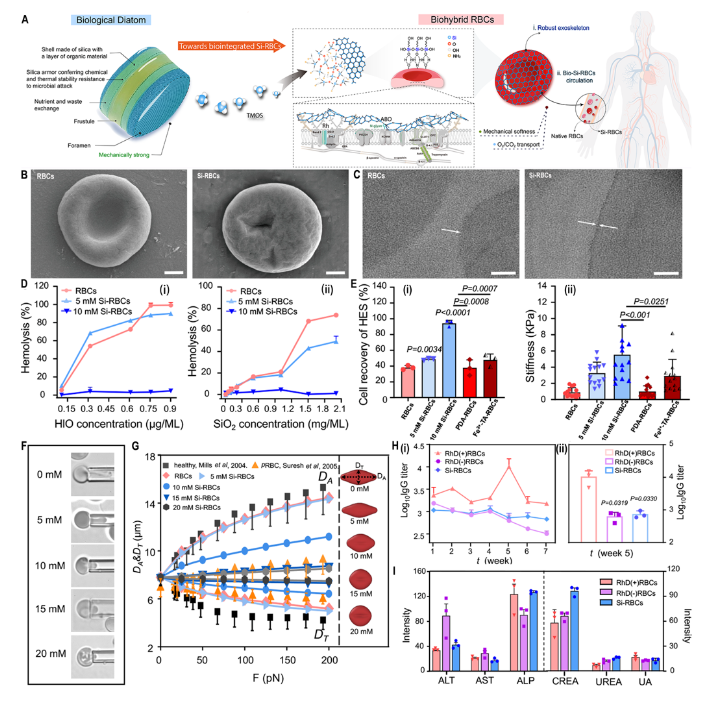
朱伟教授团队的研究受硅藻生物矿化启发,通过仿生硅化技术在红细胞表面成功构建了约25 nm厚的无定形硅层,制备得到硅化红细胞(Si-RBC),实现了对血型抗原的掩蔽。除此之外,与天然红细胞相比,Si-RBC具有相当的变形能力和更好的“抗逆境”性能,对溶血毒素、Stöber纳米颗粒造成的损伤都表现出很强的抵抗力,并且在-196°C冷冻处理后的恢复率高达天然红细胞的两倍。 在动物实验方面,研究首先通过新西兰大白兔的免疫模型验证Si-RBC的抗原掩蔽特性。研究将RhD(+)人红细胞经硅化处理后的Si-RBC对兔子进行免疫实验,结果表明硅化后的RhD(+)红细胞已不具备RhD免疫原性,证实了红细胞的表面硅化有效掩蔽了红细胞表面的抗原位点,阻断了抗体对其的识别和结合。随后,通过对BALB/c小鼠的同种异体输血验证了Si-RBC的输血安全性。对大鼠肝移植的常温机械灌注模型则验证了Si-RBC保留了在体内的携氧能力。另外,研究也尝试了将硅化后的人红细胞输注给小鼠,结果表明硅化显著降低了异种输血带来的肝肾毒性,可以在一定程度上阻止红细胞被免疫激活,具有一定的生物相容性。 评述指出,与现有酶解法或基因编辑技术相比,这项硅化技术无需破坏红细胞结构,以“无机护有机”的形式,在红细胞表面构建硅层“铠甲”,展现出硅化红细胞在不匹配输血、机械灌注以及红细胞储存实践中的巨大应用潜力。此外,评述特别强调了,尽管“通用型红细胞”的研究已取得了诸多突破性进展,输血安全依然是其中至关重要的议题,如何在长期安全输血的前提下,实现对相关抗原的精准掩蔽,解决稀有血型患者、自身免疫疾病患者、器官移植受体患者难配型的输血难题仍是未来研究的关键。 浙江大学医学院22级博士研究生章颖为论文的第一作者,王本教授为论文的通讯作者。 论文链接:https://doi.org/10.1016/j.matt.2024.11.029