Nat Chem Biol丨吕志民/许大千团队揭示代谢酶FBP1调控端粒长度与细胞衰老决定肿瘤生长的新机制
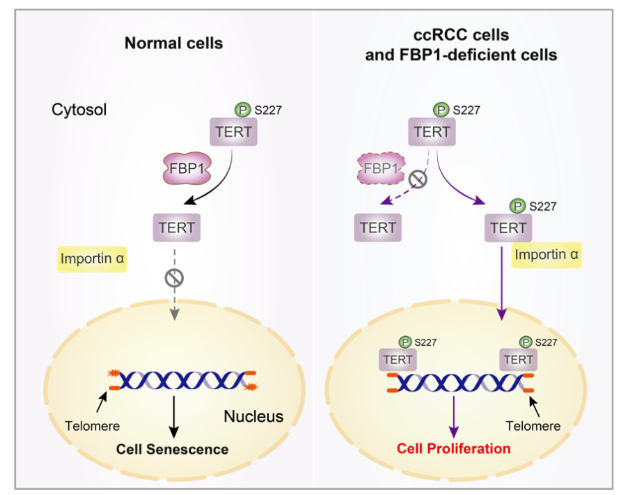
端粒(Telomeres)是位于染色体末端的DNA序列和蛋白质结构,端粒在细胞分裂过程中随着DNA复制而逐渐缩短,当端粒变得过短时,细胞便会停止分裂并进入老化状态或死亡。端粒长度和结构的稳定与肿瘤及衰老的发生密切相关,端粒长度的维持是肿瘤细胞演化过程中的一个重要环节。通常情况下,端粒的延长由端粒反转录酶(Telomerase reverse transcriptase, TERT)以RNA为模版,逆转录合成、延伸端粒DNA来完成。TERT的活性受到其磷酸化修饰的调控,AKT使TERT丝氨酸227位点磷酸化以促使importin α与TERT的核定位序列结合从而促进TERT核转位以发挥其延长端粒的功能。然而,正常细胞和癌细胞中TERT的核转位及其所依赖的端粒酶功能是否受到差异调节仍不明确。
作为生命代谢过程的主要参与者,代谢酶除了发挥其经典功能为细胞提供必要的物质和能量外,还能通过一些非经典/非代谢的功能调控多种复杂的细胞活动和肿瘤的发生发展。果糖-1, 6-二磷酸酶(fructose-1,6-bisphosphatase,FBP)是糖异生的限速酶,具有FBP1 和FBP2 两个亚型,催化果糖-1,6-二磷酸水解为果糖-6-磷酸。吕志民团队前期研究首次发现FBP1具有非经典功能,即FBP1可以做为蛋白磷酸酶去磷酸化组蛋白H3 T11磷酸化,进而抑制了PPARα介导的脂肪酸氧化相关基因的转录。然而,FBP1是否具有其他蛋白底物以及是否具有直接调节肿瘤细胞增殖的其他功能尚不清楚。
2024年3月27日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心吕志民教授/许大千研究员(共同通讯作者)在Nature Chemical Biology上在线发表了Fructose-1,6-bisphosphatase 1 dephosphorylates and inhibits TERT for tumor suppression的文章,揭示了代谢酶FBP1调控端粒长度与细胞衰老决定肿瘤生长的新机制。该项研究发现,FBP1通过其疏水残基N273与TERT相互作用,FBP1作为蛋白磷酸酶使TERT的S227位点去磷酸化,从而抑制了TERT的核转位,显著降低了端粒酶活性,减少了端粒长度,促进了细胞衰老。在动物水平上,FBP1的表达显著抑制了小鼠肿瘤生长,同时伴随TERT S227的磷酸化降低以及细胞衰老标志物表达的增加。在临床样本中也发现,TERT pS227和FBP1表达水平呈负相关,与肝癌、肾癌患者的不良预后呈负相关。重要的是,研究人员利用脂质纳米颗粒(lipid nanoparticles, LNP)靶向递送FBP1 mRNA到肿瘤组织,可以显著抑制肿瘤生长,延长小鼠生存期。本研究揭示了代谢酶FBP1作为蛋白磷酸酶对于TERT去磷酸化以及端粒酶活性的调节机制,并发现FBP1在调控细胞衰老方面的重要作用。与此同时,该研究探究了脂质纳米颗粒靶向递送FBP1 mRNA到肿瘤组织的可能性,将为肿瘤治疗新策略的开发提供新的思路和参考。

该项研究发现,FBP1通过其疏水残基N273与TERT相互作用,FBP1作为蛋白磷酸酶使TERT的S227位点去磷酸化,从而抑制了TERT的核转位,显著降低了端粒酶活性,减少了端粒长度,促进了细胞衰老。在动物水平上,FBP1的表达显著抑制了小鼠肿瘤生长,同时伴随TERT S227的磷酸化降低以及细胞衰老标志物表达的增加。在临床样本中也发现,TERT pS227和FBP1表达水平呈负相关,与肝癌、肾癌患者的不良预后呈负相关。重要的是,研究人员利用脂质纳米颗粒(lipid nanoparticles, LNP)靶向递送FBP1 mRNA到肿瘤组织,可以显著抑制肿瘤生长,延长小鼠生存期。
本研究揭示了代谢酶FBP1作为蛋白磷酸酶对于TERT去磷酸化以及端粒酶活性的调节机制,并发现FBP1在调控细胞衰老方面的重要作用。与此同时,该研究探究了脂质纳米颗粒靶向递送FBP1 mRNA到肿瘤组织的可能性,将为肿瘤治疗新策略的开发提供新的思路和参考。