Nat Cell Biol | 许大千/吕志民团队揭示肌酸代谢重塑促进肿瘤细胞铁死亡防御的重要机制
铁死亡(Ferroptosis)是一种铁依赖性的,不同于坏死、凋亡、自噬的细胞调节性死亡(regulated cell death, RCD)方式。其主要机制是,在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡;此外,还表现为铁死亡防御系统核心分子(例如:谷胱甘肽过氧化物酶4, GPX4)活性的丧失或表达量的降低。肿瘤细胞往往能够通过上调自身的铁死亡防御系统,促进其发生发展。然而,生长因子受体激活所引发的促癌信号是否直接参与铁死亡的调节仍不明确。
代谢异常是肿瘤的重要特征之一。原癌基因激活、抑癌基因失活、肿瘤细胞特有的微环境以及某些信号通路的异常活化,会在转录和翻译后修饰等多个水平上调节代谢酶或代谢调控分子,通过影响其活性、亚细胞定位、稳定性等多种机制引起代谢重编程。近年来的研究表明,肿瘤细胞不仅可以调节代谢酶的经典功能来满足自身快速增殖的需要;同时还能通过代谢酶非经典/非代谢(Moonlighting)功能调控多种复杂的细胞活动和疾病的发生发展过程。
2023年5月8日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心许大千/吕志民团队在Nature Cell Biology 杂志上发表了题为 Creatine kinase B suppresses ferroptosis by phosphorylating GPX4 through a moonlighting function 的研究论文,揭示了生长因子受体激活可以诱导能量代谢的核心酶肌酸激酶B(Creatine kinase B,CKB)发挥蛋白激酶功能,通过磷酸化GPX4抑制肿瘤细胞铁死亡。

CKB是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶。它具有代谢激酶属性,可以利用ATP作为磷酸基团供体,催化肌酸生成磷酸肌酸。许大千/吕志民团队发现在肝癌细胞中胰岛素样生长因子1受体(IGF1R)激活条件下,CKB的T133可以被AKT磷酸化,导致原本的代谢酶活性被抑制。取而代之的是,CKB获得了蛋白激酶的非经典功能,结合并磷酸化GPX4 S104。CKB介导的GPX4磷酸化抑制HSC70与GPX4的结合,延缓了GPX4的分子伴侣自噬途径的降解,提高了肿瘤细胞对铁死亡的防御能力,进而促进了肿瘤的发生发展。
本研究揭示了能量代谢核心酶CKB具有蛋白激酶的非经典功能,解析了肌酸代谢和肿瘤细胞氧化还原稳态调控的机制关联,从能量代谢重塑的角度阐明了正常肝细胞和肿瘤细胞铁死亡防御系统的差异调控机制,为靶向CKB蛋白激酶功能的抗肿瘤药物开发奠定了理论基础。
该研究是吕志民团队继发现代谢酶 PKM2 (Nature,2011;Cell,2012;Molecular Cell,2014)、PGK1(Molecular Cell,2016、2017、2019)、KHK-A(Nature Cell Biology,2016;Science Advances,2019)、PCK1(Nature,2020)、CHKα(Molecular Cell,2021)和HK2(Cell metabolism,2022)具有蛋白激酶的非经典功能之后,发现的又一个具有蛋白激酶活性的代谢酶。这些研究丰富了业界对肿瘤代谢的认知,对开拓新的肿瘤诊治方法提供了创新的理论支持。
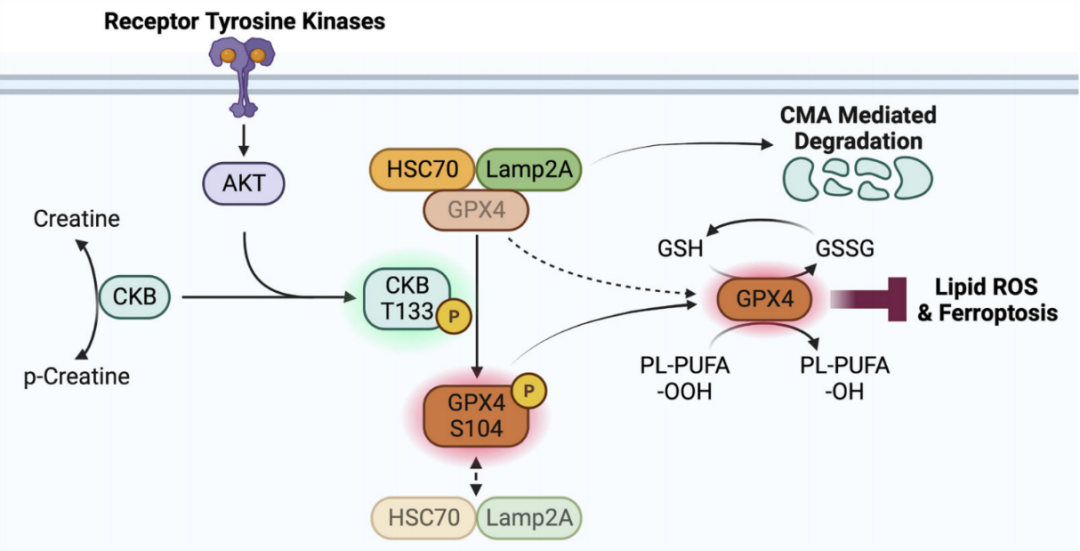
图1. 肌酸代谢重塑促进肿瘤细胞铁死亡防御的分子机制
吕志民团队现招聘助理研究员、博士后等职位,有意者可将简历发送至guodaye@zju.edu.cn(备注“应聘职位+姓名”)。


