Nat Commun丨陈静海课题组揭示心肌细胞线粒体蛋白翻译缺陷触发的线粒体与细胞核的信号互作网络调控机制
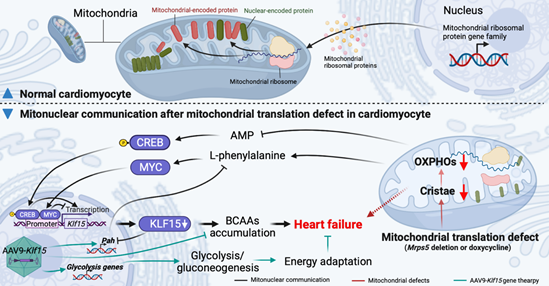
线粒体作为细胞的能量工厂,是一种半自主细胞器,由细胞核DNA (nDNA)和线粒体DNA (mtDNA)共同编码的蛋白质构成。超过 1000多种nDNA编码的蛋白质定位于线粒体内,而mtDNA编码13种蛋白质,这些蛋白质构成电子传递链(ETC)的重要组成部分,参与线粒体氧化磷酸化(OXPHOS)并产生细胞所需的ATP。线粒体内由核基因编码翻译的蛋白质与线粒体自身编码并翻译的蛋白质之间存在精密的稳定平衡,一旦打破这种平衡则触发线粒体与细胞核之间的信号互作网络调控。哺乳动物心肌细胞中含有大量的线粒体,通过氧化磷酸化产生维持心肌正常功能所需要的95%ATP,而心肌细胞线粒体与核之间的互作调控网络并不明确。

近日, 浙江大学转化医学研究院陈静海课题组联合医学院附属第二医院王建安教授团队、哈佛医学院/南佛罗里达大学王大之教授团队,在Nature Communications杂志在线发表题为“A defect in mitochondrial protein translation influences mitonuclear communication in the heart”的研究论文。
该研究揭示了线粒体自身编码蛋白翻译进程的关键调控者Mitochondrial Ribosome Protein S5 (MRPS5) 在心脏发育与生理功能中的重要作用。心肌细胞缺失MRPS5引起线粒体自身编码蛋白翻译进程停滞、线粒体结构破坏,导致线粒体氧化磷酸化代谢产能异常,心脏能量耗竭。同时MRPS5的缺失启动线粒体与细胞核的信号互作调控,通过调控代谢物L-phenylalanine与转录因子c-myc轴,以及AMP与转录因子CREB1轴,抑制下游核内关键靶基因Klf15表达。而Klf15表达下调影响支链氨基酸降解通路以及心肌肥厚等病理进程与心脏功能。通过AAV9介导的基因治疗方式在MRPS5缺失的心脏中补充Klf15显著抑制心肌肥厚与心脏纤维化等病理进程,保护心脏功能。该研究揭示了心肌中线粒体自身蛋白翻译机制缺陷触发线粒体与细胞核之间的级联网络调控,为线粒体缺陷型心肌病及心衰治疗提供了新的潜在靶标和理论基础。
本文第一作者为浙江大学医学院附属第二医院特聘研究员高峰博士,浙江大学转化医学研究院博士生梁甜为共同第一作者。浙江大学转化医学研究院/医学院附属第二医院陈静海研究员,浙江大学医学院附属第二医院王建安教授,哈佛医学院/南佛罗里达大学王大之教授为论文的共同通讯作者。该项研究工作获得国家自然科学基金、浙江省自然科学基金项目的资助。
原文链接:http://nature.com/articles/s41467-023-37291-5
参考文献:Gao F, Liang T, Lu YW, Fu X, Dong X, Pu L, Hong T, Zhou Y, Zhang Y, Liu N, Zhang F, Liu J, Malizia AP, Yu H, Zhu W, Cowan DB, Chen H, Hu X, Mably JD, Wang J, Wang DZ, Chen J. A defect in mitochondrial protein translation influences mitonuclear communication in the heart. Nat Commun. 2023 Mar 22;14(1):1595. doi: 10.1038/s41467-023-37291-5. PMID: 36949106; PMCID: PMC10033703.


