Nat Commun | 陆林宇/刘一丹团队揭示减数分裂染色体联会检查点异常激活导致卵母细胞清除
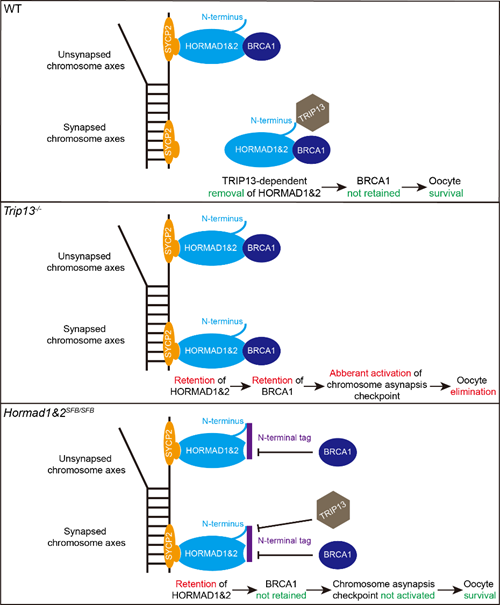
减数分裂同源重组是哺乳动物配子发生的关键步骤。在减数分裂前期,SPO11蛋白复合物程序性地产生大规模的DNA双链断裂(DSB),随后DSB通过同源重组途径进行修复。在此过程中,同源染色体发生联会,互为重组模板,为同源重组的顺利进行奠定基础。HORMAD1和HORMAD2(HORMAD1&2)是减数分裂前期特异表达的蛋白,它们定位于未联会染色体轴,起着监控染色体联会状态的重要作用。当染色体完成联会后,TRIP13将HORMAD1&2从已联会的染色体轴上移除,然而,这一过程的生物学意义尚不清楚。
为了确保配子基因组完整性和稳定性,减数分裂前期设有检查点,用于监测并清除存在重组障碍的生殖细胞。在卵母细胞中,减数分裂前期检查点位于原始卵泡库建立之前,是卵母细胞质量控制的关键环节。该团队2024年发表的研究工作发现,染色体联会检查点很可能是卵母细胞减数分裂前期检查点的主要方式,而BRCA1是此检查点的重要成员。与体细胞中BRCA1定位于DSB位点不同,在减数分裂前期,BRCA1特异地定位于未联会染色体轴上。
2025年3月6日,浙江大学转化医学研究院/医学院附属妇产科医院陆林宇/刘一丹团队在Nature Communications杂志上发表了题为Aberrant activation of chromosome asynapsis checkpoint triggers oocyte elimination的研究论文,揭示当HORMAD1&2异常滞留在已联会染色体轴上时,会通过BRCA1激活减数分裂染色体联会检查点,导致卵母细胞清除。

该研究首先发现,Trip13敲除小鼠的卵母细胞在出生后迅速被清除,但被清除前DSB已被完全修复。这一现象表明,Trip13敲除小鼠卵母细胞的清除并非如以往研究所认为的那样由DNA损伤检查点激活所驱动。为了探究Trip13敲除小鼠中异常滞留在已联会染色体轴上的HORMAD1&2对卵母细胞清除的潜在贡献,研究团队构建了Hormad1&2SFB/SFB小鼠模型。该模型通过在HORMAD1&2的N端添加标签,阻断了TRIP13与HORMAD1&2的结合,从而将两者直接滞留在已联会染色体轴上。
有趣的是,Hormad1&2SFB/SFB小鼠的卵母细胞并未像Trip13敲除小鼠那样被清除。进一步研究发现,在Trip13敲除小鼠的卵母细胞中,BRCA1异常滞留在已联会染色体轴上,而在Hormad1&2SFB/SFB小鼠的卵母细胞中,BRCA1并未出现这种滞留。更为重要的是,Brca1条件性敲除可以显著拯救Trip13敲除小鼠卵母细胞的存活。这些结果表明,BRCA1在已联会染色体轴上的异常滞留激活了卵母细胞减数分裂染色体联会检查点,从而导致Trip13敲除小鼠的卵母细胞被清除。机制研究发现,HORMAD1通过一种非经典模式,利用其N端附近区域与BRCA1结合,并将其招募至染色体轴。而在Hormad1&2SFB/SFB小鼠中,N端标签的添加破坏了HORMAD1与BRCA1的结合,导致BRCA1无法滞留在已联会的染色体轴上,从而避免了染色体联会检查点的激活。这一发现不仅解释了Hormad1&2SFB/SFB小鼠卵母细胞未被清除的原因,还揭示了HORMAD1&2通过调控BRCA1定位在卵母细胞质量控制中的关键作用。
总结来说,HORMAD1&2从已联会染色体轴上的及时解离对于维持卵母细胞存活和原始卵泡库储备具有重要的生理意义。这一过程避免BRCA1在染色体轴上的滞留,防止减数分裂染色体联会检查点的异常激活,确保卵母细胞的正常发育。相反,如果HORMAD1&2和/或BRCA1异常滞留在已联会染色体轴上,则会激活减数分裂染色体联会检查点,最终导致卵母细胞的清除。
陆林宇/刘一丹团队博士后焦晓飞、已毕业博士生梁中洋和博士生李佶玮为该论文的共同第一作者。浙江大学医学院附属妇产科医院白龙特聘副研究员和浙江大学转化医学研究院许军研究员参与了部分研究工作。陆林宇教授和刘一丹副教授为该论文的共同通讯作者。
陆林宇为浙江大学转化医学研究院全职PI,同时双聘于浙江大学医学院附属妇产科医院。课题组主要研究方向为DNA损伤修复与生殖细胞发育,特别关注减数分裂同源重组,主要利用小鼠与细胞模型进行研究,并与临床紧密合作。课题组长期招收博士后,欢迎申请。课题组主页:https://person.zju.edu.cn/lulinyu
原文链接:https://www.nature.com/articles/s41467-025-57702-z


