Nat Commun | 吕志民团队合作揭示替莫唑胺在脑胶质瘤治疗中“矛”与“盾”的双面作用
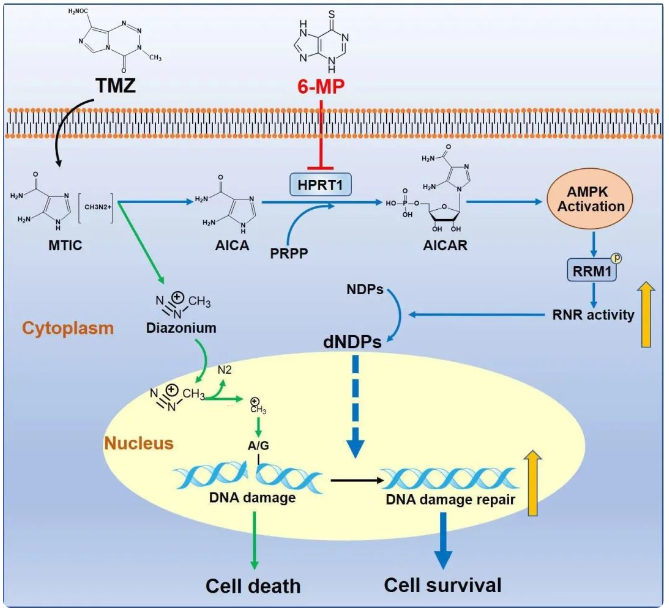
2005年Roger Stupp等研究人员证实,术后放疗联合替莫唑胺(Temozolomide, TMZ)化疗可延长胶质母细胞瘤患者生存期。自此之后,以TMZ为化疗基石的Stupp方案已成为新诊断胶质母细胞瘤(Glioblastoma, GBM)标准治疗方案。然而患者经TMZ化疗后预后收益并不理想。相较于单一放疗方案,放疗联合TMZ化疗仅使患者中位生存期延长2.5个月,中位无进展生存期延长1.9个月。为寻找TMZ治疗效果不理想的原因,研究团队将目光重新聚焦在TMZ药物本身。TMZ是二代口服烷化剂,进入细胞后在生理条件下产生两种代谢产物:重氮甲烷和5-氨基-咪唑-4 酰胺(AICA)。重氮甲烷造成DNA甲基化并引起DNA损伤,导致肿瘤细胞死亡。长期以来,基础和临床研究聚焦于肿瘤细胞如何抵御TMZ来源的重氮甲烷造成的DNA损伤,忽视了AICA作为TMZ的另一个代谢产物是否在TMZ治疗耐受中发挥作用。
2023年9月22日,浙江大学转化医学研究院、浙江大学医学院附属第一医院、国家基础科学中心吕志民教授、南京医科大学公共卫生学院钱旭教授与南京医科大学第一附属医院神经外科尤永平教授团队在Nature Communications杂志上发表一篇题为 Hypoxanthine phosphoribosyl transferase 1 metabolizes temozolomide to activate AMPK for driving chemoresistance of glioblastomas 的文章,他们首次发现TMZ衍生的代谢产物AICA可激活AMPK促进肿瘤细胞对TMZ产生化疗耐药。这一发现,打破既往对TMZ的认知,揭示TMZ是“矛与盾”的复合体,应重新审视TMZ可能存在的“自身缺陷”,进一步探索如何克服“盾”的作用来更好发挥其“矛”的优势,从而有效提高TMZ临床治疗效果。

AMPK是维持细胞稳态的关键“调节器”, 对肿瘤细胞的生命活动如增殖、凋亡、侵袭转移等具有重要影响。5-氨基咪唑-4-羧化核糖体-5-磷酸(AICAR)是AMPK内源激动剂。该项研究发现,TMZ来源的AICA可显著激活AMPK信号通路。通过对分子结构对比分析发现,AICA与AICAR结构高度相似,AICAR仅比AICA多一个核糖-5-磷酸结构。通过合成的15N-TMZ同位素示踪联合质谱检测发现,TMZ源性AICA可生成AICAR。针对目前已知的磷酸核糖转移酶进行筛选发现,AICA在次黄嘌呤磷酸核糖转移酶1(HPRT1)催化反应下可生成AICAR。HPRT1敲低或失活突变可显著抑制TMZ源性AICA对AMPK信号通路激活的激活。
GBM对TMZ产生耐药的主要机制是DNA损伤修复,其中脱氧核糖核苷酸作为原料,是影响DNA损伤修复进程的关键。该研究发现,激活的AMPK可磷酸化修饰核糖核苷酸还原酶(RNR)催化亚基RRM1 T52位点,增强其催化效率,促进脱氧核糖核苷酸生成,加速肿瘤细胞DNA损伤修复。突变RRM1 T52位点可显著抑制脱氧核糖核苷酸生成,增加肿瘤细胞对TMZ的敏感性。
最后,在临床转化方面,联合使用HPRT1抑制剂6巯基嘌呤(6-MP),有助于提高胶质瘤对TMZ的敏感性。研究人员还发现HPRT1水平与复发胶质瘤样本中AMPK/RRM1轴激活水平成正相关,高水平HPRT1预示着肿瘤患者的不良预后。
综上,该研究揭示GBM化疗耐药新机制:HPRT1催化TMZ代谢产物AICA转变为AICAR以激活AMPK信号通路,促使AMPK磷酸化RRM1,提高核糖核苷酸还原酶活性,加快DNA合成速率和损伤修复能力,驱动GBM化疗耐药。基于本项目研究成果,尤永平教授研究团队正在开展“6-巯基嘌呤联合替莫唑胺治疗复发胶质母细胞瘤的疗效和安全性研究”前瞻性、单臂临床研究。
浙江大学转化医学研究院、浙江大学医学院附属第一医院、国家基础科学中心吕志民教授、南京医科大学公共卫生学院钱旭教授与南京医科大学第一附属医院神经外科尤永平教授为该论文共同通讯作者。南京医科大学姑苏学院博士后尹建星、南京医科大学第一附属医院神经外科王协锋副教授和南京医科大学公共卫生学院葛新副教授为该论文共同第一作者。
原文链接:https://www.nature.com/articles/s41467-023-41663-2


