PNAS | 躲避肿瘤的“糖衣炮弹”,王本/张进合作报道免疫检查点基因编辑的巨噬细胞
唾液酸是一种普遍表达于真核细胞表面的带负电的9碳糖蛋白。通过与细胞表面糖复合物的末端形成糖苷键,唾液酸可以有效地掩盖细胞表面的抗原和识别位点,防止免疫系统识别和吞噬细胞。大部分肿瘤细胞表面的唾液酸高表达,而且高表达唾液酸的肿瘤细胞具有生长优势,并与患者的不良预后呈正相关(1, 2)。细胞膜上存在一类受体家族,可以识别唾液酸多糖,例如选择素或唾液酸结合免疫球蛋白样凝集素(Siglec)。Siglecs在免疫系统的大多数细胞中表达,并可以在结合唾液酸配体后传递免疫抑制信号。肿瘤细胞对Siglec配体的亲和性增加可能是肿瘤细胞免疫逃逸的机制之一。现行的肿瘤免疫疗法大部分基于已知的免疫检查点如PD-1、CTLA-4和CD47等,但其在部分病人中疗效有限,且针对巨噬细胞缺乏临床上有效的免疫检查点药物。因此,迫切需要寻找肿瘤免疫治疗中针对巨噬细胞的免疫检查点分子,并针对性地开发新型的肿瘤免疫疗法。
2023年9月12日,浙江大学转化医学研究院/医学院附属第二医院王本课题组与良渚实验室/浙江大学基础医学院的张进课题组合作在美国科学院院刊(PNAS)上发表了题为Targeted glycan degradation potentiates cellular immunotherapy for solid tumors的论文。该研究发现了唾液酸酶与人诱导多能干细胞(iPSC)来源的CAR-巨噬细胞(CAR-iMac)联用可以显著增强CAR-iMac的抗实体瘤功能。另外,同时敲除巨噬细胞表面与唾液酸酶结合的免疫检查点Siglec-5和Siglec-10(DKO-CAR-iMac)也可以显著增强CAR-iMac的抗实体瘤功能。这些发现为髓系细胞在细胞免疫治疗上的应用提供了新思路。CAR-T细胞的先驱宾夕法尼亚大学的Carl June教授是这篇文章的责任编辑。

外周血单核细胞(PBMC)来源的原代巨噬细胞无法高效进行基因编辑和工程化改造,因此iPSC来源的巨噬细胞(iMac)成为髓系细胞免疫治疗的重要来源(3)。研究者们首先用唾液酸酶预处理卵巢癌细胞SKOV3,并将SKOV3细胞与靶向间皮素的CAR-iMac(MSLN-CAR-iMac)共培养。结果表明,唾液酸酶的预处理不会影响肿瘤细胞自身的生长速度,但可以显著提高MSLN-CAR-iMac对卵巢癌细胞的吞噬能力。研究者们还发现,唾液酸酶的预处理提高了共培养体系中M1型CAR-iMac的比例和肿瘤坏死因子α(TNF-α)的分泌(图一)。
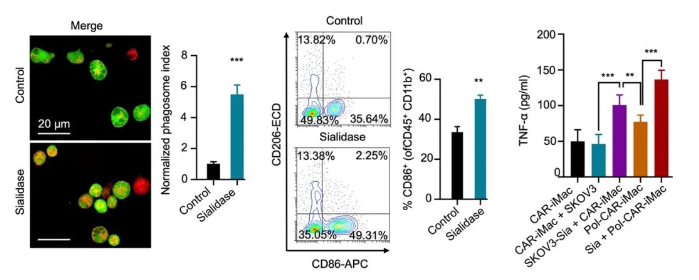
图一. 唾液酸酶提高了CAR-iMac的促炎极化水平和对肿瘤细胞的吞噬能力
研究者们又用NSG小鼠构建了卵巢癌转移小鼠模型,并观察了通过腹腔注射CAR-iMac和唾液酸酶治疗后小鼠肿瘤的变化。可以看到,单独的唾液酸酶几乎没有治疗作用,而唾液酸酶与CAR-iMac联用可以显著抑制肿瘤生长并延长了小鼠的生存期(图二)。后续在胰腺癌小鼠模型中与原位卵巢癌小鼠模型中也分别观察到唾液酸酶与CAR-iMac联用可以显著延长小鼠的生存期(图三)。
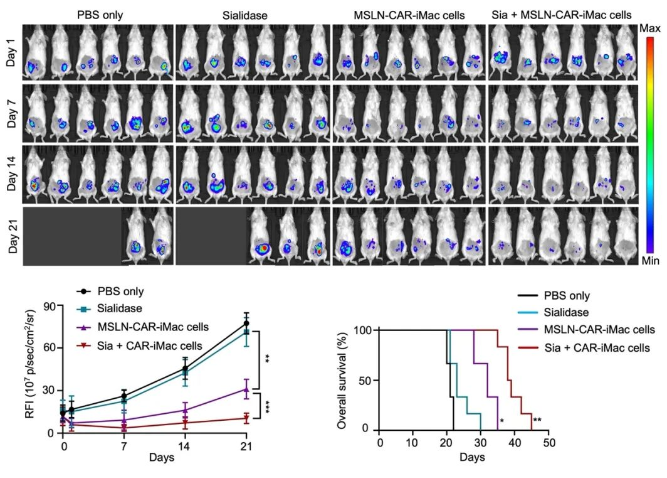
图二. 在卵巢癌转移小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效。
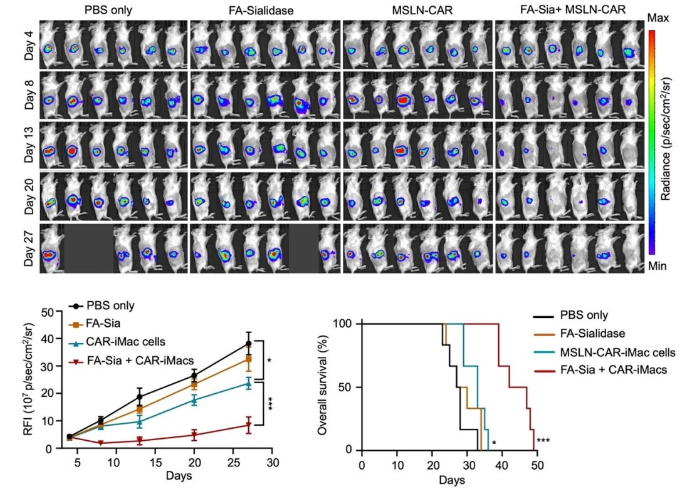
图三. 在原位卵巢癌小鼠模型中,唾液酸酶与CAR-iMAC联用可以显著提高疗效。
为了探索唾液酸酶增强CAR-iMac抗肿瘤功能的机制,研究者们分析了iMac分化过程中和iMac与肿瘤细胞共培养过程中各种唾液酸受体Siglecs的表达情况,将可能发挥作用的唾液酸受体定位在Siglec-1、Siglec-5、Siglec-10和Siglec-15。又进一步通过中和抗体试验定位于Siglec-5和Siglec-10两个唾液酸受体。于是,研究者们利用CRISPR-Cas9技术在iPSC中同时敲除了Siglec-5和Siglec-10,并通过诱导分化获得Siglec-5和Siglec-10双敲的CAR-iMac(DKO-CAR-iMac)。后续的实验结果表明,DKO-CAR-iMac具有增强的肿瘤细胞吞噬能力和杀伤能力,显著抑制小鼠体内肿瘤细胞的生长,并延长了小鼠的生存期。DKO-CAR-iMac单独给药的疗效可以达到CAR-iMac与唾液酸酶联用的疗效,而且DKO-CAR-iMac与唾液酸酶联用无法进一步提升其疗效(图四)。
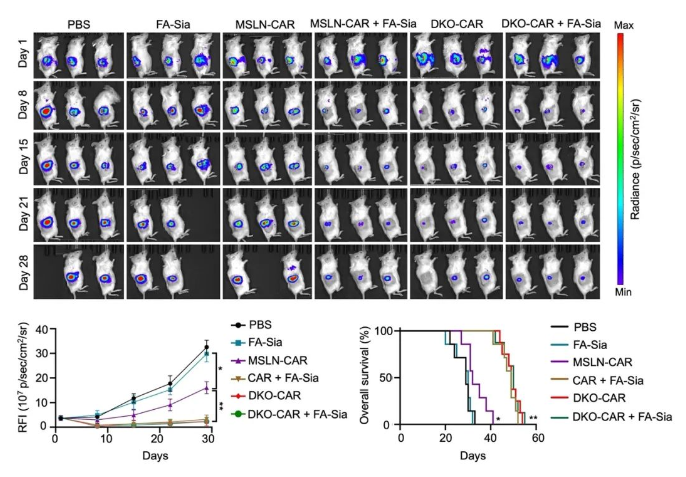
图四. DKO-CAR-iMac具有增强的抗肿瘤疗效
综合来看,该研究发现了肿瘤细胞表面的唾液酸在抗体依赖性细胞吞噬(ADCP)和细胞介导的细胞毒性(ADCC)中的抑制作用,有针对性地清除肿瘤细胞表面的唾液酸显著增强了巨噬细胞对肿瘤细胞的敏感性。此外,以肿瘤靶向分子为载体的唾液酸酶偶联物能够有效且选择性地去除各种肿瘤细胞的不同唾液酸糖链,去唾液酸化增强了CAR-iMac的浸润和激活,并且在卵巢癌和胰腺癌小鼠模型中观察到显著增强的肿瘤抑制能力和显著延长的小鼠生存期。这些效应主要依赖于巨噬细胞表面Siglec-5和Siglec-10免疫检查点的阻断。Siglec-5和Siglec-10双敲的CAR-iMac(DKO-CAR-iMac)也具有显著增强的肿瘤杀伤能力。因此,唾液酸酶联合CAR-iMac,或者敲除CAR-iMac上的免疫检查点是实现巨噬细胞对实体肿瘤高效杀伤的有效方法。
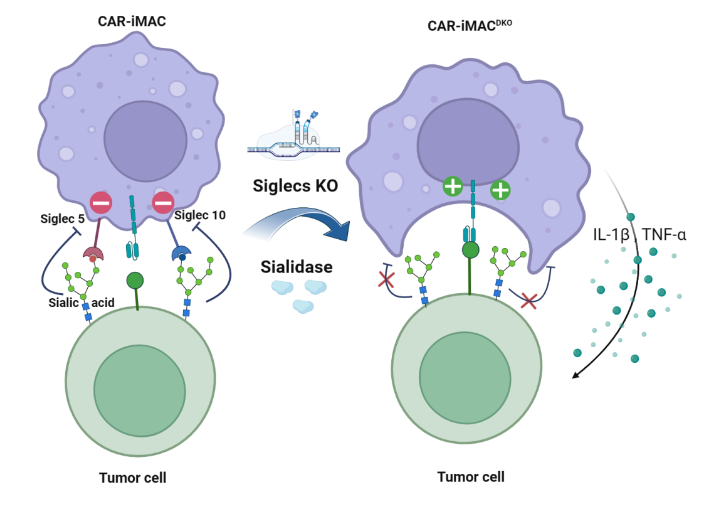
图五. 唾液酸酶和DKO-CAR-iMac的作用机制示意图
浙江大学转化医学研究院/医学院附属第二医院的王本教授和良渚实验室/基础医学院/医学院附属第一医院的张进研究员是本文的共同通讯作者。王本课题组的2018级博士生伍继成(现武汉大学附属人民医院肿瘤内科医生)、张进课题组的2018级博士生王旭东(已毕业)和王本课题组的2020级硕士生黄裕乔是本文的共同第一作者。其他作者包括王本课题组的张云敬、寿昊、王浩然和张进课题组的苏锶钰都为本研究做出了重要贡献。本研究受到国家重点研发计划、国家自然科学基金和中央高校基本科研经费支持。
课题组常年招收博士后、科研助理,欢迎具有免疫学、肿瘤学、化学背景的博士加盟团队,共创美好未来。邮箱: benwang@zju.edu.cn
原文链接:https://www.pnas.org/eprint/Q5WAVNUZZJUW2NH4TGFA/full
参考文献
1.K. Ding, A. Yamaguchi, T. Goi, M. Maehara, G. Nakagawara, Lectin-histochemical reactivity of sialic acid in breast cancer and its relationship to prognosis using limulus polyphemus agglutinin. International Journal of Oncology 10, 759-763 (1997).
2.C. Feijoo, M. Páez de la Cadena, F. J. Rodríguez-Berrocal, V. S. Martínez-Zorzano, Sialic acid levels in serum and tissue from colorectal cancer patients. Cancer Letters 112, 155-160 (1997).
3.L. Zhang et al., Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions. Journal of Hematology & Oncology 13, 153 (2020).


