PNAS丨张普民团队揭示同源重组核心蛋白RAD51调控表观基因组稳定性的分子机制
2024年12月3日,浙江大学转化医学研究院/浙江大学医学院附属第一医院张普民教授团队在美国科学院院刊PNAS (Proceedings of the National Academy of Sciences of the United States of America)在线发表了题为“RAD51 plays critical roles in DNMT1-mediated maintenance methylation of genomic DNA by dually regulating the ubiquitin ligase UHRF1”的研究论文。该研究发现了同源重组修复核心蛋白RAD51调控表观基因组(Epigenome)稳定性的新功能,RAD51通过调控甲基转移酶DNMT1蛋白稳态及其招募从而维持全基因组DNA甲基化水平的稳态,并为人类遗传病先天性镜像移动(CMM)疾病发生机制提供了新的见解。

基因组DNA甲基化是调控染色质结构和基因表达的主要表观遗传机制。在胚胎早期发育阶段,DNA甲基转移酶DNMT3A和3B负责从头开始对基因组进行甲基化,从而建立DNA甲基化模式。此后,由DNA甲基转移酶DNMT1负责维持这种甲基化模式,DNMT1不能单独完成这项任务,它需要UHRF1作为辅因子,帮助它识别CpG位点并进行甲基化。UHRF1是一种泛素样蛋白,具有PHD和环指结构域。它在维持DNA甲基化中发挥着重要作用,通过其E3连接酶活性将泛素添加到组蛋白H3的K18和K23残基上,以及PAF15的K15和K24残基上。泛素修饰的组蛋白H3是DNMT1募集到半甲基化位点并进行甲基化的重要信号。
重组酶RAD51在同源重组修复中发挥着关键作用。有趣的是,RAD51也是人类先天性镜像运动(CMM)中发生突变的基因之一。CMM是一种常染色体显性遗传病,特征是当患者有意移动身体一侧时,另一侧也会发生不自主的镜像运动。除了RAD51之外,DCC和DNAL4基因的突变也会导致CMM,而这两个基因都与神经发育有关。目前还不清楚为什么RAD51在CMM中会出现单倍性不足(haploinsufficient),但人类疾病遗传学研究表明,RAD51很可能具有独立于DNA损伤修复的新功能,对于基因表达或神经发育发挥着重要作用。然而,人们对于RAD51参与基因表达或神经发育的分子机制的理解仍然十分有限。
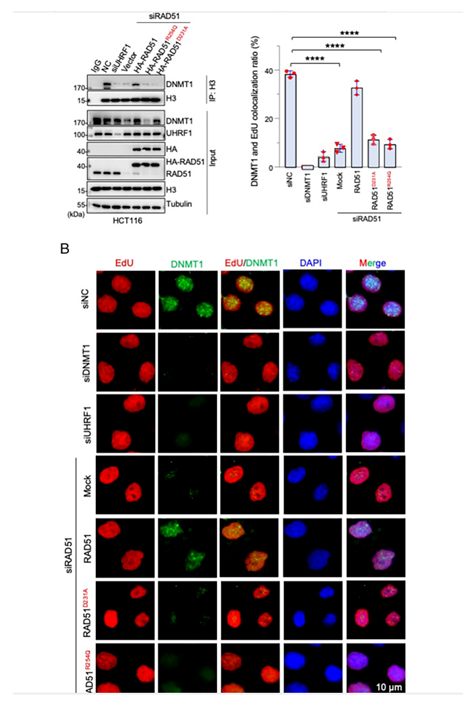
RAD51促进DNMT1在染色质上的招募
在本研究中,作者揭示了重组酶RAD51独立于其经典功能(同源重组修复)的新功能:维持表观基因组的稳态。第一,作者结合质谱和生化技术发现RAD51通过与E3连接酶UHRF1相互作用并抑制UHRF1的E3连接酶活性。RAD51的缺失导致作为UHRF1底物DNMT1的过度泛素化及降解,最终导致基因组DNA甲基化水平下降。第二,RAD51还是一个组蛋白H3阅读器(Reader)。RAD51与组蛋白H3存在直接相互作用,该相互作用有利于UHRF1与H3结合并泛素化H3以产生DNMT 1募集信号。破坏RAD51和H3之间的相互作用可引起H3泛素化降低,DNMT1的招募受阻,进而致使基因组甲基化水平下降。进一步,作者发现 PC12细胞在神经生长因子诱导的分化过程中,RAD51抑制神经突生长,这种抑制依赖于其在维持基因组DNA甲基化中的功能,该结果为RAD51作为CMM致病基因提供了合理解释。
综上,该研究揭示了基因组DNA甲基化稳态调控的新机制,同时阐明了RAD51在维持基因组和表观基因组稳定性方面都发挥着重要作用。
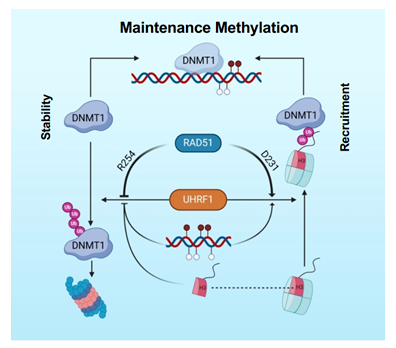
RAD51调控基因组DNA甲基化稳态模式图
浙江大学医学院附属第一医院特聘研究员刘光学为论文第一作者,张普民教授为该论文通讯作者。在项目实施过程中,华东师范大学翁杰敏教授,浙江大学梁廷波教授,浙江大学医学院附属第一医院黄金艳教授提供了大力支持与帮助。该论文得到国家自然科学基金、浙江省自然科学基金及浙江大学医学院附属第一医院特聘研究员启动经费等项目的经费支持。


