PNAS | 孙毅团队揭示拟素化/泛素化修饰调控胱氨酸转运蛋白SLC7A11的稳定性和细胞铁死亡
细胞死亡是生命体在生长发育以及组织清除多余或受损细胞的一个基本生理过程,作为新陈代谢的环节之一,其对维持机体正常稳态有重要意义(1)。肿瘤的特征性细胞死亡抵抗主要体现在肿瘤细胞进化出各种策略限制或避免死亡,进而赋予肿瘤细胞优于正常细胞的特异性增殖能力。铁死亡是新近发现的一种新型程序性死亡形式,通过特定化合物或调控相关基因的表达诱导铁死亡,可以抑制肿瘤细胞的增殖、侵袭、转移;同时,通过诱导铁死亡,可以增加如抗肿瘤放化疗及免疫治疗的功效(2),因此,铁死亡是近年来肿瘤治疗方法的热点研究方向。揭示铁死亡的调控机制,将为肿瘤发病机理的认识提供全新的突破口,并为其临床靶向治疗提供新的策略与手段。
2024年7月3日,浙江大学转化医学研究院/浙江大学医学院附属第二医院肿瘤研究所孙毅教授团队在PNAS发表题为The CRL3KCTD10 ubiquitin ligase-USP18 axis coordinately regulates cystine uptake and ferroptosis by modulating SLC7A11的研究论文,报道了E3泛素连接酶CRL3KCTD10和去泛素化酶USP18协同调控胱氨酸转运蛋白SLC7A11的稳定性,从而调控肿瘤细胞的胱氨酸吸收和铁死亡。

拟素化 (neddylation) 是一种调节蛋白活性或功能但不介导其被26S蛋白酶体降解的蛋白质翻译后修饰,其过程与泛素化过程类似,通过三联酶促反应将拟素NEDD8与目标蛋白共价结合。拟素化修饰的生理性底物为Cullin家族蛋白, Cullin的拟素化激活Cullin-RING ligase (CRL) E3泛素连接酶,负责细胞内经泛素-蛋白酶体信号通路降解蛋白的泛素化。因此,拟素化修饰与蛋白泛素化降解紧密关联(3)。孙毅课题组前期通过非靶向代谢组学研究,发现拟素化修饰在整体上显著调控细胞代谢(4),细胞代谢通路通过分析显示谷氨酰胺代谢变化最为显著。阻断拟素化修饰后,肿瘤细胞谷氨酰胺吸收及其代谢显著增加(5)。在一些肿瘤中,为维持谷氨酰胺代谢的有序进行,谷氨酰胺代谢产物谷氨酸需外排至细胞外并将胞外胱氨酸运送至细胞内,而催化此反应的是谷氨酸与胱氨酸交换的关键转运蛋白SLC7A11(6, 7)。基于此,课题组发现拟素化修饰抑制后,培养基上清中胱氨酸含量显著降低,且SLC7A11水平增加;同时,细胞中敲减SLC7A11,可逆转抑制拟素化修饰所诱导的胱氨酸吸收,提示:抑制拟素化修饰,使CRL E3泛素连接酶功能失活,导致SLC7A11累积,促进细胞胱氨酸摄取及其代谢。
为明确拟素化修饰抑制后SLC7A11累积的机制,课题组通过一系列遗传学筛选和生物化学实验发现:CRL3KCTD10E3连接酶促进SLC7A11的K48连接的多聚泛素化降解,进而降低其稳定性。而去泛素化酶USP18去除SLC7A11泛素化修饰,从而增加SLC7A11蛋白的稳定性。在胱氨酸胁迫环境中,SLC7A11和KCTD10相互作用减弱并抑制KCTD10对其泛素化作用,而SLC7A11和USP18相互作用增加并增强USP18对其去泛素化作用,进而促进SLC7A11的累积。鉴于SLC7A11在胱氨酸吸收和细胞铁死亡中的重要作用,作者验证了KCTD10和USP18通过靶向SLC7A11,分别负向和正向调控胱氨酸的摄取和细胞铁死亡。
由于抑制拟素化导致的细胞胱氨酸吸收对肿瘤细胞存活有保护作用,研究者使用拟素化抑制剂小分子MLN4924联合SLC7A11抑制剂Erastin(或IKE),体外细胞实验及体内肿瘤模型实验结果均显示同时靶向拟素化通路和胱氨酸吸收可显著抑制肿瘤细胞增殖。研究结果为MLN4924联合用药提出了可行的方案。
为探究此发现的临床意义,课题组分析了人体乳腺癌肿瘤组织样本,发现KCTD10呈低表达而USP18和SLC7A11高表达状态,KCTD10和SLC7A11呈负相关性,而USP18与SLC7A11呈正相关性。从癌旁到癌组织,KCTD10表达逐渐降低,而USP18和SLC7A11表达逐渐增高。最后,课题组发现乳腺癌组织中胱氨酸含量低于癌旁组织,说明乳腺癌对胱氨酸有高吸收和代谢,而肿瘤微环境中胱氨酸含量的降低,会重塑肿瘤细胞中KCTD10和USP18的水平来调控SLC7A11的稳定性,从而进一步调控肿瘤细胞对胱氨酸的吸收和代谢。
周启银和俞鸿飞博士为论文共同第一作者,博士生陈永霞协助完成了部分实验,浙江大学转化医学研究院陆燕教授及团队成员任珈仪在生信分析中提供了重要帮助,孙毅教授为通讯作者。
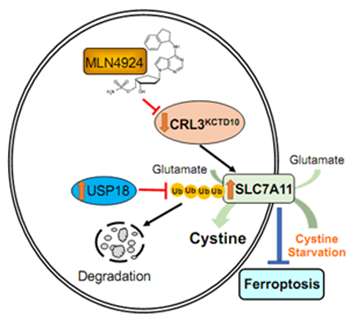
CRL3KCTD10负向而USP18正向调控SLC7A11,从而调控胱氨酸的摄取和细胞铁死亡。
References:
1. A. Strasser, D. L. Vaux, Cell Death in the Origin and Treatment of Cancer. Molecular cell 78, 1045-1054 (2020).
2. B. R. Stockwell, Ferroptosis turns 10: Emerging mechanisms, physiological functions, and therapeutic applications. Cell 185, 2401-2421 (2022).
3.S. Zhang, Q. Yu, Z. Li, Y. Zhao, Y. Sun, Protein neddylation and its role in health and diseases. Signal Transduct Target Ther 9, 85 (2024).
4.Q. Zhou et al., Inhibiting neddylation modification alters mitochondrial morphology and reprograms energy metabolism in cancer cells. JCI insight 4 (2019).
5.Q. Zhou et al., Neddylation inhibition induces glutamine uptake and metabolism by targeting CRL3(SPOP) E3 ligase in cancer cells. Nature communications 13, 3034 (2022).
6.L. A. Timmerman et al., Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target. Cancer cell 24, 450-465 (2013).
7.A. Muir et al., Environmental cystine drives glutamine anaplerosis and sensitizes cancer cells to glutaminase inhibition. eLife 6 (2017).


