Trends in Cancer丨吕志民团队深入解析短链脂肪酸在肿瘤调控中的关键作用
短链脂肪酸(short chain fatty acids, SCFAs)作为人体肠道微生物代谢的关键产物,构成连接饮食、肠道微生物组、代谢、免疫系统的重要桥梁。SCFAs主要包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等,它们在增强肠道功能、抑制炎症、调节免疫反应、保护心脑血管、维持神经系统健康、预防肥胖、改善糖尿病等方面发挥着重要作用,其失衡与多种疾病的发病机制密切有关,包括胃肠疾病、自身免疫疾病、心血管疾病、神经退行性疾病和癌症。
2024年12月4日,浙江大学转化医学研究院、浙江大学医学院附属第一医院、国家基础科学中心及浙江大学基础交叉研究院吕志民教授团队在Trends in Cancer在线发表了题为Short-chain fatty acids and cancer的综述文章,全面总结了SCFAs在肿瘤进展中的生物学特性和多样化功能。文章特别强调了SCFAs在基因表达、细胞增殖、细胞死亡和免疫应答方面的作用,并探讨了基于SCFAs的癌症预防和治疗策略的潜力。这是继2018年的Regulation of chromatin and gene expression by metabolic enzymes and metabolites(Nat Rev Mol Cell Bio| 表观遗传学与代谢的交叉)、Metabolic Kinases Moonlighting as Protein Kinases(Trends in Biochemical Sciences.)、2020年的Lipid metabolism and cancer(JEM综述 | 吕志民等揭示脂质代谢与肿瘤发生发展的相互关系)、2021年的The evolving landscape of noncanonical functions of metabolic enzymes in cancer and other pathologies (Cell Metab综述 | 吕志民团队总结代谢酶在癌症等疾病发生发展中的非经典功能)、2022年的Regulation of gene expression by glycolytic and gluconeogenic enzymes(Trends Cell Biol | 吕志民团队全面总结糖代谢酶对基因表达的调控)以及2023年的The interplay of the circadian clock and metabolic tumorigenesis (Trends Cell Biol丨吕志民团队总结生物钟紊乱与肿瘤代谢的相互调控)六篇综述之后,吕志民教授团队对肿瘤代谢新认知的又一系统总结。
SCFAs在肿瘤细胞内通过多种分子机制发挥作用。能量代谢与大分子合成:SCFAs作为细胞的能量来源,通过β-氧化过程在细胞的线粒体中转化为ATP,为细胞活动提供必需的能量。同时,它们也是合成大分子,如脂质等的代谢前体,参与细胞的代谢活动。细胞信号传导:SCFAs能够激活G蛋白偶联受体(GPCRs),在细胞信号传导中扮演关键角色,影响细胞的代谢、增殖和炎症反应。染色质重塑与基因表达:SCFAs是组蛋白去乙酰化酶(HDAC)的天然抑制剂,它们通过增强组蛋白的乙酰化重塑染色质结构,进而调节与肿瘤相关的基因表达和肿瘤发展的进程。蛋白质酰基化修饰:SCFAs衍生的酰基辅酶A作为酰基供体,参与蛋白质的酰基化修饰,包括乙酰化、丙酰化、丁酰化和异丁酰化等。这些修饰作用于组蛋白和非组蛋白,调控基因表达,影响细胞周期、分化和死亡等关键生物学过程,对肿瘤细胞的生长和存活产生重要影响。非组蛋白的酰基化修饰还能调节蛋白质的稳定性、亚细胞定位、蛋白质间相互作用、酶活性和信号转导,从而精细调控细胞生物学过程(图1)。通过这些分子机制,SCFAs在肿瘤细胞的代谢、信号传导、基因表达调控以及细胞生物学过程中扮演着多面手的角色,对肿瘤的发展和治疗响应具有深远的影响。
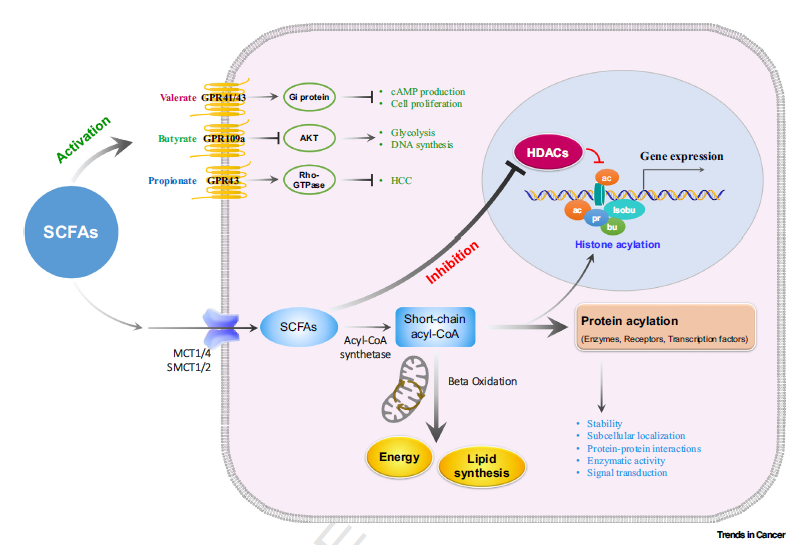
图1. 短链脂肪酸分子作用机制
在肿瘤的发展过程中,SCFAs发挥着复杂而关键的双重作用。一方面,乙酸通过促进能量代谢、脂质生物合成和基因表达,特别是通过c-Myc介导的GLUT1、cyclin D1和PD-L1的表达,支持肿瘤细胞的生长和增殖。这些过程增强了Warburg效应,肿瘤细胞对抗能量应激的能力,促进了G1-S期的转换以及免疫逃逸(Nat Metab | 吕志民团队揭示肿瘤细胞喜欢“吃醋”以促进肿瘤免疫逃逸(2024))。另一方面,丁酸、丙酸和戊酸通过诱导肿瘤细胞周期停滞和促进细胞死亡,包括凋亡、铁死亡和铜死亡等多种形式,显著抑制肿瘤的发展。此外,SCFAs还通过调节肠道微生物群、免疫细胞功能和肿瘤微环境,发挥抗肿瘤免疫的调节作用(图2)。
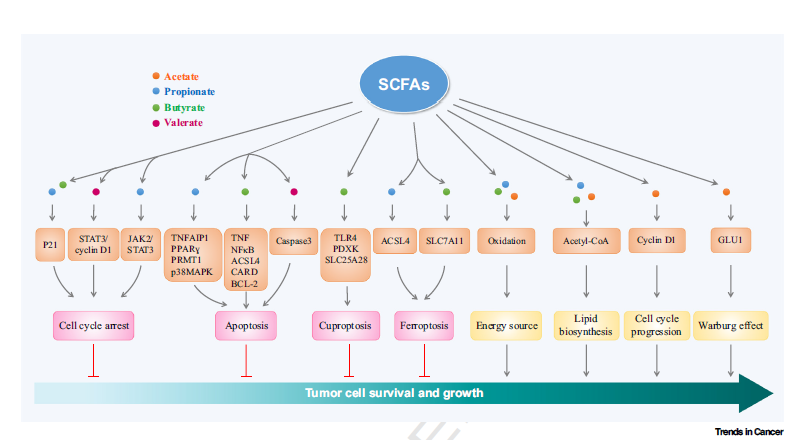
图2. 短链脂肪酸对肿瘤细胞生长与存活的双重效应
当前研究表明,SCFAs在维持机体生理平衡和调控肿瘤发展中扮演着关键角色,这揭示了针对SCFA相关细胞途径在癌症防治中的潜力。通过饮食调整、补充益生菌和SCFAs,可以调节SCFA的生物利用度和代谢,进而影响癌症的预防和治疗。此外,SCFAs与化疗、放疗和免疫疗法的联合应用显示出增强治疗效果的潜力,尽管这些研究大多还处于实验室阶段,需要进一步的临床研究来确认其临床效果和安全性。
吕志民教授团队的这一综述文章,为深入理解SCFAs在肿瘤进展中的作用机制提供了系统视角,并为未来的研究方向和临床应用提供了宝贵的指导。文章特别强调了将SCFAs与现有治疗手段相结合的重要性,并指出了深入研究SCFAs剂量和时间依赖性效应,以实现精准、高效的个性化治疗是未来研究的关键。
结语:
随着对SCFAs功能的深入研究,我们期待开发出更高效和个性化的癌症综合治疗方案。吕志民教授团队的研究成果不仅为肿瘤代谢领域提供了新的见解,也为未来的癌症治疗提供了新的思路和策略。
https://www.cell.com/trends/cancer/abstract/S2405-8033(24)00255-3


