J Clin Invest丨孙毅团队揭示UBE2C/CDH1/DEPTOR轴调控Kras^G12D肺癌生长的作用及机制
肺癌是全球范围内发病率和死亡率最高的癌症,每年新发肺癌的人数在180万左右,死亡人数大约为160万。非小细胞肺癌(NSCLC)是最常见的肺癌类型,主要包括肺腺癌和鳞癌,占肺癌所有病理类型的80%。研究发现,约25-30%的肺腺癌中存在原癌基因Kras突变【1】。多种促癌基因可与Kras突变协同促进肺癌的发生发展。
UBE2C是泛素连接酶APC/C(Anaphase-Promoting Complex/Cyclosome)的特异性E2泛素耦联酶。数项体外细胞实验表明UBE2C是一个促癌因子【2-4】,其对肺癌细胞自噬的抑制作用与肿瘤细胞生长及恶性表型密切相关【5】;UBE2C高表达与肺癌患者的不良预后也密切相关【5-8】。但是,UBE2C是否在体内直接促进肺癌的发生发展以及其潜在的分子机制目前仍然不清楚。
含DEP结构域的雷帕霉素靶蛋白相互作用蛋白 (DEP Domain Containing MTOR Interacting Protein, DEPTOR) 是雷帕霉素靶蛋白 (mTOR) 的重要的负调控因子。DEPTOR最初被认为是肿瘤抑制因子,其在多种肿瘤中表达下调;DEPTOR缺失通过激活mTORC1和mTORC2信号促进肿瘤细胞生长 【9-17】。但也有研究表明DEPTOR在某些环境中也可以发挥促癌的作用【18-23】。特别是在肺癌中,DEPTOR是发挥抑癌或促癌作用仍不明确
最近,浙江大学转化医学研究院/浙江大学医学院附属第二医院肿瘤研究所孙毅教授团队在Journal of Clinical Investigation杂志上发表了题为The UBE2C/CDH1/DEPTOR axis is an oncogene-tumor suppressor cascade in lung cancer cells的研究论文。

该研究通过条件性基因敲除鼠模型证明Ube2c可协同KrasG12D诱导小鼠肺肿瘤的发生发展;分子机制研究发现UBE2C可以与APC/CCDH1 E3连接酶结合促进DEPTOR的泛素化修饰和降解,从而激活下游mTORC信号通路发挥细胞自噬抑制作用,促进肿瘤生长。在KrasG12D肺癌小鼠模型中也证实同时敲除 Deptor在很大程度上可以消除Ube2c 敲除导致的肿瘤生长抑制作用。因此,UBE2C在KrasG12D诱导的肺癌中发挥促癌作用是基于泛素化降解抑癌蛋白DEPTOR的作用。该研究明确了UBE2C-APC/CCDH1是介导DEPTOR泛素化降解的一种新的E2/E3,同时也证明了UBE2C是促进KrasG12D肺癌发生发展的协助因子,有望成为治疗KrasG12D突变肺癌的新靶标。
具体来说,研究人员首先使用在线TCGA数据库分析发现UBE2C过表达与肺腺癌患者的不良预后相关;进一步通过体外细胞实验证实UBE2C表达对于携带Kras突变的肺癌细胞的生长和存活是至关重要。在探索UBE2C如何发挥促癌作用的分子机制过程中,研究人员发现DEPTOR蛋白表达水平在细胞周期进程中呈现出波动性,在G1期表达水平最低;而在G1期泛素连接酶APC/CCDH1的活性处于高活动状态,因此假设APC/CCDH1可能调控DEPTOR蛋白表达水平。通过一系列生化实验最终证实DEPTOR是APC/CCDH1的一个新底物蛋白,UBE2C与APC/CCDH1偶联,通过识别结合DEPTOR蛋白的D-box序列,促进DEPTOR蛋白发生泛素化降解;DEPTOR表达水平降低后可以激活下游mTORC信号通路,发挥细胞自噬抑制作用及促进肺癌细胞生长。因此,UBE2C通过泛素化降解抑癌蛋白DEPTOR而发挥促癌作用。
更为重要的是,研究人员通过基因敲除小鼠模型验证了Ube2c的促癌作用及Deptor的抑癌作用。研究人员将Ube2c条件性敲除鼠(Ube2cfl/fl)与LSL-KrasG12D肺癌模型鼠交配,以研究Ube2c在肺肿瘤发生中的作用,结果发现Ube2c在小鼠肺组织中敲除后显着降低了肿瘤负荷并延长了小鼠存活时间。随后研究人员将Deptor 敲除鼠(Deptor-/-)与Kras(+)Ube2c-/-小鼠交配,研究Deptor敲除的回补作用,结果显示Deptor 的敲除几乎完全消除了Ube2c 敲除对小鼠肺部肿瘤生长的抑制作用,进一步证实了UBE2C与DEPTOR的促癌和抑癌作用关系。
总之,该研究通过体外实验及小鼠体内实验证明了Ube2c是KrasG12D诱导的肺肿瘤发生过程中的重要协同基因:在KrasG12D诱导的肺肿瘤发生过程中,Ube2c被Kras诱导,随后与Apc/cCdh1泛素连接酶结合,促进肿瘤抑制因子Deptor的泛素化降解,进而激活下游mTorc(S6k1和Akt), 与KrasG12D(Mapk)信号通路一起诱导肺肿瘤的发生发展。因此,UBE2C可望成为治疗KrasG12D突变相关肺癌的有效靶点。
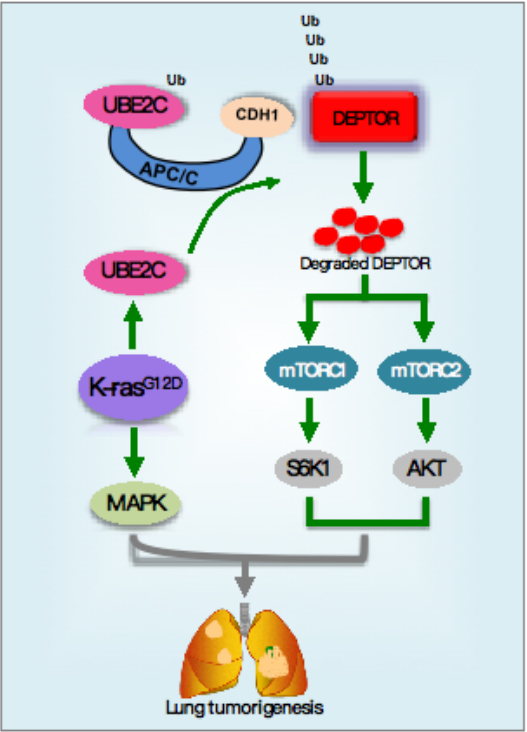
图1: 研究机制模式图
本文第一作者为浙江大学医学院附属第二医院乳腺外科主治医师章时珍,浙江大学转化医学研究院博士生游霞红和郑雅文为共同第一作者。浙江大学转化医学研究院/浙江大学医学院附属第二医院肿瘤研究所孙毅教授为本文通讯作者。
原文链接:
https://www.jci.org/articles/view/162434
参考文献
1. Ferrer I, Zugazagoitia J, Herbertz S, John W, Paz-Ares L, and Schmid-Bindert G. KRAS-Mutant non-small cell lung cancer: From biology to therapy. Lung cancer (Amsterdam, Netherlands). 2018;124:53-64.
2. Xie C, Powell C, Yao M, Wu J, and Dong Q. Ubiquitin-conjugating enzyme E2C: a potential cancer biomarker. The international journal of biochemistry & cell biology. 2014;47(113-7.
3. Okamoto Y, Ozaki T, Miyazaki K, Aoyama M, Miyazaki M, and Nakagawara A. UbcH10 is the cancer-related E2 ubiquitin-conjugating enzyme. Cancer research. 2003;63(14):4167-73.
4. Arvand A, Bastians H, Welford SM, Thompson AD, Ruderman JV, and Denny CT. EWS/FLI1 up regulates mE2-C, a cyclin-selective ubiquitin conjugating enzyme involved in cyclin B destruction. Oncogene. 1998;17(16):2039-45.
5. Guo J, Wu Y, Du J, Yang L, Chen W, Gong K, Dai J, Miao S, Jin D, and Xi S. Deregulation of UBE2C-mediated autophagy repression aggravates NSCLC progression. Oncogenesis. 2018;7(6):49.
6. Zhao L, Jiang L, Wang L, He J, Yu H, Sun G, Chen J, Xiu Q, and Li B. UbcH10 expression provides a useful tool for the prognosis and treatment of non-small cell lung cancer. Journal of cancer research and clinical oncology. 2012;138(11):1951-61.
7. Perrotta I, Bruno L, Maltese L, Russo E, Donato A, and Donato G. Immunohistochemical analysis of the ubiquitin-conjugating enzyme UbcH10 in lung cancer: a useful tool for diagnosis and therapy. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 2012;60(5):359-65.
8. Kariri Y, Toss MS, Alsaleem M, Elsharawy KA, Joseph C, Mongan NP, Green AR, and Rakha EA. Ubiquitin-conjugating enzyme 2C (UBE2C) is a poor prognostic biomarker in invasive breast cancer. Breast cancer research and treatment. 2022;192(3):529-39.
9. Chen X, Xiong X, Cui D, Yang F, Wei D, Li H, Shu J, Bi Y, Dai X, Gong L, et al. DEPTOR is an in vivo tumor suppressor that inhibits prostate tumorigenesis via the inactivation of mTORC1/2 signals. Oncogene. 2020;39(7):1557-71.
10. Wang Z, Zhong J, Inuzuka H, Gao D, Shaik S, Sarkar FH, and Wei W. An evolving role for DEPTOR in tumor development and progression. Neoplasia. 2012;14(5):368-75.
11. Gong L, Shu J, Chen X, Pan H, Chen G, Bi Y, Cui D, Li X, Liu D, Wang L, et al. DEPTOR inhibits lung tumorigenesis by inactivating the EGFR-mTOR signals. Cancer Lett. 2021;519(263-76.
12. Li H, Sun GY, Zhao Y, Thomas D, Greenson JK, Zalupski MM, Ben-Josef E, and Sun Y. DEPTOR has growth suppression activity against pancreatic cancer cells. Oncotarget. 2014;5(24):12811-9.
13. Lai EY, Chen ZG, Zhou X, Fan XR, Wang H, Lai PL, Su YC, Zhang BY, Bai XC, and Li YF. DEPTOR Expression Negatively Correlates with mTORC1 Activity and Tumor Progression in Colorectal Cancer. Asian Pac J Cancer Prev. 2014;15(11):4589-94.
14. Zhou X, Guo J, Ji Y, Pan G, Liu T, Zhu H, and Zhao J. Reciprocal Negative Regulation between EGFR and DEPTOR Plays an Important Role in the Progression of Lung Adenocarcinoma. Molecular cancer research : MCR. 2016;14(5):448-57.
15. Ji YM, Zhou XF, Zhang J, Zheng X, Li SB, Wei ZQ, Liu T, Cheng DL, Liu P, Song K, et al. DEPTOR suppresses the progression of esophageal squamous cell carcinoma and predicts poor prognosis. Oncotarget. 2016;7(12):14188-98.
16. Doan H, Parsons A, Devkumar S, Selvarajah J, Miralles F, and Carroll VA. HIF-mediated Suppression of DEPTOR Confers Resistance to mTOR Kinase Inhibition in Renal Cancer. iScience. 2019;21(509-20.
17. Yao H, Tang H, Zhang Y, Zhang QF, Liu XY, Liu YT, Gu WT, Zheng YZ, Shang HB, Wang Y, et al. DEPTOR inhibits cell proliferation and confers sensitivity to dopamine agonist in pituitary adenoma. Cancer letters. 2019;459(135-44.
18. Peterson TR, Laplante M, Thoreen CC, Sancak Y, Kang SA, Kuehl WM, Gray NS, and Sabatini DM. DEPTOR is an mTOR inhibitor frequently overexpressed in multiple myeloma cells and required for their survival. Cell. 2009;137(5):873-86.
19. Chen J, Zhu H, Liu Q, Ning D, Zhang Z, Zhang L, Mo J, Du P, Liu X, Song S, et al. DEPTOR induces a partial epithelial-to-mesenchymal transition and metastasis via autocrine TGFβ1 signaling and is associated with poor prognosis in hepatocellular carcinoma. Journal of experimental & clinical cancer research : CR. 2019;38(1):273.
20. Pei L, Xie P, Zhou E, Yang Q, Luo Y, and Tang Z. Overexpression of DEP domain containing mTOR-interacting protein correlates with poor prognosis in differentiated thyroid carcinoma. Mol Med Rep. 2011;4(5):817-23.
21. Hu Y, Su H, Liu C, Wang Z, Huang L, Wang Q, Liu S, Chen S, Zhou J, Li P, et al. DEPTOR is a direct NOTCH1 target that promotes cell proliferation and survival in T-cell leukemia. Oncogene. 2017;36(8):1038-47.
22. Bi Y, Chen X, Wei B, Wang L, Gong L, Li H, Xiong X, and Zhao Y. DEPTOR stabilizes ErbB2 to promote the proliferation and survival of ErbB2-positive breast cancer cells. Theranostics. 2021;11(13):6355-69.
23. Wang Q, Zhou Y, Rychahou P, Harris JW, Zaytseva YY, Liu J, Wang C, Weiss HL, Liu C, Lee EY, et al. Deptor Is a Novel Target of Wnt/β-Catenin/c-Myc and Contributes to Colorectal Cancer Cell Growth. Cancer research. 2018;78(12):3163-75


